题目内容
 电解原理在工业有广泛的应用.利用相关知识回答下面的问题.
电解原理在工业有广泛的应用.利用相关知识回答下面的问题.(1)铝的阳极氧化:在进行电解以前,要对铝电极进行表面处理,是将铝片浸入热的16%NaOH溶液中半分钟左右,目的是
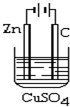
(2)电解原理的运用:在如图装置中,溶液的体积为100mL,开始时电解质溶液的浓度为0.1mol/L,工作一段时间后导线上通过0.001mol电子.若不考虑盐的水解和溶液体积的变化,则电解后溶液的pH值为
(3)电镀是运用电解原理,在金属表面形成一薄层有抗腐蚀、抗磨损能力的金属镀膜的过程.例如:在铜片上电镀银时,电解原理是:采用AgNO3溶液为电解质,用
A.FeCl2 B.CuCl2 C.K6[Cu(P2O7)2]D.CuSO4.
考点:电解原理
专题:电化学专题
分析:(1)金属铝性质活泼,表面形成一层致密的氧化膜,可以喝氢氧化钠之间反应,生成偏铝酸钠盐溶液,据此回答;
(2)根据电解原理方程式进行计算;
(3)电镀时用镀层金属为阳极,镀件为阴极,含有镀层金属离子的溶液为电解质溶液,因此采用铜为阳极,铜的络离子电离出的铜离子浓度小.
(2)根据电解原理方程式进行计算;
(3)电镀时用镀层金属为阳极,镀件为阴极,含有镀层金属离子的溶液为电解质溶液,因此采用铜为阳极,铜的络离子电离出的铜离子浓度小.
解答:
解:(1)对铝电极进行表面处理,可以除去铝材表面的自然氧化膜,反应的离子方程式为:Al2O3+2OH-=H2O+2AlO2-或Al2O3+2OH-+3H2O=2Al[(OH)4]-,
故答案为:除去表面的氧化膜;Al2O3+2OH-=2AlO2-+H2O或Al2O3+2OH-+3H2O=2Al[(OH)4]-;正极;
(2)用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气、阴极上铜离子放电生成Cu,离子方程式为2Cu2++2H2O
2Cu+O2↑+4H+,导线上通过0.001mol电子,产生氢离子的物质的量是0.001mol,所以氢离子浓度是0.01mol/L,故pH=2,故答案为:2;
(3)电镀时用镀层金属为阳极,镀件为阴极,含有镀层金属离子的溶液为电解质溶液,因此采用铜为阳极,铜的络离子电离出的铜离子浓度小,析出均匀与底层金属的附着力强,故答案为:Ag;C.
故答案为:除去表面的氧化膜;Al2O3+2OH-=2AlO2-+H2O或Al2O3+2OH-+3H2O=2Al[(OH)4]-;正极;
(2)用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气、阴极上铜离子放电生成Cu,离子方程式为2Cu2++2H2O
| ||
(3)电镀时用镀层金属为阳极,镀件为阴极,含有镀层金属离子的溶液为电解质溶液,因此采用铜为阳极,铜的络离子电离出的铜离子浓度小,析出均匀与底层金属的附着力强,故答案为:Ag;C.
点评:本题考查金属的性质、电解、电镀以及金属的腐蚀及防护知识,考查较为综合,做题时注意把握好电解、电镀等知识的原理,了解金属的防护措施,难度不大,但要注意知识的积累,厚积而薄发.

练习册系列答案
相关题目
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A、在NaHA溶液中一定有:c(Na+)>c(HA-)>c(OH-)>c(H+) |
| B、0.1mol/L(NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
| C、0.2 mol?L-1CH3COOH溶液和0.2 mol?L-1CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol?L-1 |
| D、pH相等的①NH4Cl ②(NH4)2SO4③NH4HSO4溶液中,c (NH4+)大小顺序为①=②>③ |
已知:①向MnO2固体中加入浓盐酸,加热后充分反应,产生黄绿色气体,②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③向KMnO4晶体滴加浓盐酸,产生黄绿色气体.下列判断正确的为( )
| A、实验②证明Fe2+既有氧化性又有还原性 |
| B、实验③生成的气体不能使湿润的淀粉KI试纸变蓝 |
| C、上述实验中,有三个氧化还原反应 |
| D、上述实验证明氧化性:MnO2>MnO4->Cl2>Fe3+ |
臭氧的化学式为O3.a molO3和a molO2具有相同的( )
| A、原子数 | B、分子数 |
| C、体积 | D、质量 |
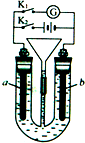 在如图所示装置中,U形管内装满稀H2SO4,a为铁电极,b为多孔石墨电极.
在如图所示装置中,U形管内装满稀H2SO4,a为铁电极,b为多孔石墨电极.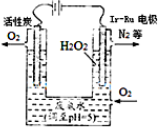 最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图
最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图 已知水在25℃和100℃时,其电离平衡曲线如图所示:
已知水在25℃和100℃时,其电离平衡曲线如图所示: