题目内容
 已知水在25℃和100℃时,其电离平衡曲线如图所示:
已知水在25℃和100℃时,其电离平衡曲线如图所示:(1)25℃时,水的离子积为
(2)若向25℃的水中滴加少量冰醋酸,C(H+)
(3)若向100℃的水中加入少量Ag2CrO4固体,一段时间后,达到Ag2CrO4的沉淀溶解平衡,该温度下溶度积的表达式Ksp (Ag2CrO4)=
考点:弱电解质在水溶液中的电离平衡,水的电离,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:(1)c(H+).c(OH-)=Kw,水的电离是吸热反应,升高温度促进电离;
(2)若向25℃的水中滴加少量冰醋酸,促进醋酸的电离,电离方程式为:CH3COOH?CH3COO-+H+;
(3)根据溶度积的定义去解.
(2)若向25℃的水中滴加少量冰醋酸,促进醋酸的电离,电离方程式为:CH3COOH?CH3COO-+H+;
(3)根据溶度积的定义去解.
解答:
解:(1)水的电离是吸热反应,升高温度促进电离,所以25℃时,水的电离对应曲线为A,即Kw=c(H+).c(OH-)=1.0 X 10-14,故答案为:1.0 X 10-14;
(2)若向25℃的水中滴加少量冰醋酸,促进醋酸的电离,所以氢离子浓度变大,电离方程式为:CH3COOH?CH3COO-+H+,故答案为:变大;CH3COOH?CH3COO-+H+;
(3)根据溶度积的定义,等于电离产生离子的浓度幂之积,所以Ksp (Ag2CrO4)=C2(Ag+)?C(CrO42-),故答案为:C2(Ag+)?C(CrO42-).
(2)若向25℃的水中滴加少量冰醋酸,促进醋酸的电离,所以氢离子浓度变大,电离方程式为:CH3COOH?CH3COO-+H+,故答案为:变大;CH3COOH?CH3COO-+H+;
(3)根据溶度积的定义,等于电离产生离子的浓度幂之积,所以Ksp (Ag2CrO4)=C2(Ag+)?C(CrO42-),故答案为:C2(Ag+)?C(CrO42-).
点评:本题考查离子积常数公式、溶度积和弱电解质的电离,比较综合.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
下列反应能生成氢气的是( )
| A、碳与浓硫酸加热反应 |
| B、Na2CO3与稀盐酸反应 |
| C、铜与稀硝酸反应 |
| D、铝与氢氧化钠溶液反应 |
下列各组离子能在同一溶液里大量共存的是( )
| A、Na+、Al3+、Cl-、AlO2- |
| B、Mg2+ NO3- Fe2+、H+ |
| C、Fe3+、SO42-、Na+、SCN- |
| D、K+、Na+、AlO2-、CO32- |
下列反应既是化合反应,又是氧化反应的是( )
A、2CO+O2
| ||||
| B、CaO+H2O=Ca(OH)2 | ||||
C、C+H2O
| ||||
| D、CO2+Ca(OH)2=CaCO3↓+H2O |
在光照条件下,将a mol甲烷与足量Cl2反应,测知四种产物的物质的量比依次2:1:1:2,则耗Cl2的物质的量为( )
| A、a mol |
| B、1.25a mol |
| C、2.5a mol |
| D、4a mol |
用NA表示阿伏伽德罗常数的值,下列说法不正确的是( )
| A、常温下,1mol甲烷含有的氢原子数为4NA |
| B、2g氦气所含有原子数为0.5NA |
| C、0.1mol/L的硫酸铝溶液中含SO42-数为0.3NA |
| D、18g水所含质子数为10NA |

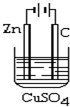 电解原理在工业有广泛的应用.利用相关知识回答下面的问题.
电解原理在工业有广泛的应用.利用相关知识回答下面的问题.