题目内容
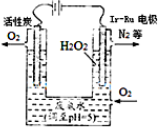 最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图
最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图①为了不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)
②Ir-Ru惰性电极有吸附O2作用,该电极上的反应为
③理论上电路中每转移3mol电子,最多可以处理NH3?H2O的物质的量为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:①根据溶液呈电中性,溶液中阳离子所带的正电荷总数等于溶液中阴离子所带的负电荷总数进行解答;
②在该电解池中,Ir-Ru惰性电极有吸附O2作用为氧气得电子发生还原反应,在酸性条件下生成过氧化氢;
③根据4NH3+3O2?2N2+6H2O,每转移12mol电子,处理4mol氨气,据此分析解答.
②在该电解池中,Ir-Ru惰性电极有吸附O2作用为氧气得电子发生还原反应,在酸性条件下生成过氧化氢;
③根据4NH3+3O2?2N2+6H2O,每转移12mol电子,处理4mol氨气,据此分析解答.
解答:
解:①向废氨水加入适量硝酸调节溶液的pH约为5,根据溶液呈电中性,溶液中c(NH4+)+c(H+)=c(NO3-)+c(OH-),pH约为5呈酸性,c(H+)>c(OH-),所以
c(NH4+)<c(NO3-),故答案为:<;
②利用电解法制H2O2,在该电解池中,Ir-Ru惰性电极有吸附O2作用为氧气得电子发生还原反应,O2+2H++2e-═H2O2,故答案为:O2+2H++2e-═H2O2;
③4NH3+3O2?2N2+6H2O中,氨气中的氮元素从-3价变为氮气中的0价,4mol氨气转移12mol电子,所以转移3mol电子,最多可以处理NH3?H2O的物质的量为1mol,
故答案为:1mol.
c(NH4+)<c(NO3-),故答案为:<;
②利用电解法制H2O2,在该电解池中,Ir-Ru惰性电极有吸附O2作用为氧气得电子发生还原反应,O2+2H++2e-═H2O2,故答案为:O2+2H++2e-═H2O2;
③4NH3+3O2?2N2+6H2O中,氨气中的氮元素从-3价变为氮气中的0价,4mol氨气转移12mol电子,所以转移3mol电子,最多可以处理NH3?H2O的物质的量为1mol,
故答案为:1mol.
点评:本题考查了离子浓度大小比较、电极反应式书写、氧化还原反应中据电子守恒的计算,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
如图为水果电池的示意图,下列说法正确的是( )


| A、锌片作负极,质量逐渐减少 |
| B、电子由铜片沿导线流向锌片 |
| C、铜电极逐渐溶解 |
| D、该装置能将电能转化为化学能 |
有关物质用途的说法正确的是( )
| A、二氧化硅可用作半导体材料 |
| B、明矾可用于水的杀菌消毒 |
| C、碳酸氢钠可用于治疗胃酸过多 |
| D、硅可用于制造光导纤维 |
下列各组离子能在同一溶液里大量共存的是( )
| A、Na+、Al3+、Cl-、AlO2- |
| B、Mg2+ NO3- Fe2+、H+ |
| C、Fe3+、SO42-、Na+、SCN- |
| D、K+、Na+、AlO2-、CO32- |
 将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示. 电解原理在工业有广泛的应用.利用相关知识回答下面的问题.
电解原理在工业有广泛的应用.利用相关知识回答下面的问题.