题目内容
11.下列元素的原子在形成不同物质时,既能形成离子键,又能形成共价键的是( )| A. | K | B. | Ca | C. | Cl | D. | Ar |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,据此分析解答.
解答 解:A.K是活泼金属,易失去电子,所以易和其它元素形成离子键,不能形成共价键,故A错误;
B.Ca是活泼金属,易失去电子,所以易和其它元素形成离子键,不能形成共价键,故C错误;
C.Cl是活泼非金属元素,易得电子,易和活泼金属元素形成离子键,易和非金属元素形成共价键,故C正确;
D.Ar原子最外层有8个电子,性质稳定,不易形成离子键和共价键,故D错误;
故选C.
点评 本题考查离子键和共价键,为高频考点,侧重考查基本概念,明确离子键和共价键根本区别是解本题关键,题目难度不大.

练习册系列答案
相关题目
1. 在3支试管中分别放有:①1mL乙酸乙酯和3mL水 ②1mL四氯化碳和3mL水 ③1mL乙酸和3mL水.图中三支试管从左到右的排列顺序为( )
在3支试管中分别放有:①1mL乙酸乙酯和3mL水 ②1mL四氯化碳和3mL水 ③1mL乙酸和3mL水.图中三支试管从左到右的排列顺序为( )
 在3支试管中分别放有:①1mL乙酸乙酯和3mL水 ②1mL四氯化碳和3mL水 ③1mL乙酸和3mL水.图中三支试管从左到右的排列顺序为( )
在3支试管中分别放有:①1mL乙酸乙酯和3mL水 ②1mL四氯化碳和3mL水 ③1mL乙酸和3mL水.图中三支试管从左到右的排列顺序为( )| A. | ①②③ | B. | ①③② | C. | ②①③ | D. | ②③① |
2.已知A、B为短周期元素,它们的原子最外层电子数相同,且A的原子半径小于B,若m为正整数,则下列说法正确的是( )
| A. | 若HAOm是强酸,则HBOm也一定为强酸 | |
| B. | 若B为非金属元素,则A可能为金属元素,若B为金属元素,则A可能为非金属元素 | |
| C. | 常温下,若B的简单氢化物是气体,则A的简单氢化物可能是液体 | |
| D. | 若B(OH)m是强碱,则A(OH)m也是强碱 |
19.短周期主族元素A、B、C、D的原子序数依次增大,A、B、C原子的最外层电子数之和为12,B、C、D位于同一周期,C原子的最外层电子数既是A原子内层电子数的3倍又是B原子最外层电子数的3倍.下列说法正确的是( )
| A. | 原子半径:B>A,离子半径:C<D | |
| B. | B的单质能与A的最高价氧化物发生置换反应 | |
| C. | 元素B和D能形成BD2型的共价化合物 | |
| D. | D的单质有毒,且有漂白性 |
6.下列化学用语或模型表示正确的是( )
| A. | 氚原子符号:H | B. | H2O2分子结构式:H-O-O-H | ||
| C. | Mg2+结构示意图: | D. | HF的形成过程  |
16.根据有机化合物的命名原则,下列命名正确的是( )
| A. | 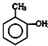 甲基苯酚 甲基苯酚 | |
| B. | 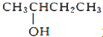 2-羟基丁烷 2-羟基丁烷 | |
| C. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | |
| D. | CH2=CH-CH=CH-CH=CH2 1,3,5-己三烯 |
3.下列叙述中正确的是( )
| A. | NH3、CO、CO2都是极性分子 | |
| B. | CH4、CCl4都是含有极性键的极性分子 | |
| C. | 因为非羟基氧原子数目逐渐减少,所以酸性HClO4>H2SO4>H3PO4>HClO | |
| D. | CS2、H2O、C2H2都是直线形分子 |
20.下列物质中,属于电解质的有( )
| A. | 乙酸 | B. | 乙醇 | C. | 油脂 | D. | 氯化钠 |
1.下列实验操作或结论正确的是( )
| A. | 将NH3通入AgN03溶液中,再加几滴葡萄糖溶液,加热后有银镜产生,证明葡萄糖有氧化性 | |
| B. | 配制Fe(N03)2溶液时,向Fe(N03)2溶液中加几滴稀硫酸,以防止Fe(N03)2发生水解 | |
| C. | 向NaI溶液中加入少量CCl4振荡,未见蓝色,说明NaI没有变质 | |
| D. | 剪取一小块铝箔,投入到NaOH溶液中,观察到在被剪断处先产生气体,说明铝在空气中易被氧化 |