题目内容
3.下列叙述中正确的是( )| A. | NH3、CO、CO2都是极性分子 | |
| B. | CH4、CCl4都是含有极性键的极性分子 | |
| C. | 因为非羟基氧原子数目逐渐减少,所以酸性HClO4>H2SO4>H3PO4>HClO | |
| D. | CS2、H2O、C2H2都是直线形分子 |
分析 A.结构对称、正负电荷中心重叠的分子为非极性分子;
B.结构对称、正负电荷中心重叠的分子为非极性分子;
C.非羟基氧原子数目越少,含氧酸的酸性越弱;
D.根据分子的中心原子的价层电子对数判断.
解答 解:A.NH3的空间结构为三角锥形,结构不对称,属于极性分子,CO结构不对称属于极性分子,CO为直线形分子,结构对称、正负电荷中心重叠为非极性分子,故A错误;
B.CH4、CCl4都是正四面体结构,结构对称、正负电荷中心重叠,为非极性分子,故B错误;
C.非羟基氧原子数目越少,含氧酸的酸性越弱,HClO4、H2SO4、H3PO4、HClO的非羟基氧原子数目分别为3、2、1、0,所以酸性HClO4>H2SO4>H3PO4>HClO,故C正确;
D.CS2分子的中心原子的价层电子对数为2+$\frac{1}{2}$(4-2×2)=2,没有孤电子对,为直线形分子,H2O分子的中心原子的价层电子对数为2+$\frac{1}{2}$(6-2×1)=4,有2个孤电子对,为V形分子,C2H2分子为直线形分子,故D错误.
故选C.
点评 本题考查了非极性分子与极性分子的判断、含氧酸酸性强弱比较,题目难度不大,注意把握分子极性的判断方法.

练习册系列答案
相关题目
13.下列分子中,所有原子的最外层均为8电子结构的是( )
| A. | BeCl2 | B. | H2S | C. | NCl3 | D. | BF3 |
14.短周期元素W、X、Y和Z的原子序数依次增大.元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )
| A. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| B. | 元素X的单质能与其最高价氧化物反应 | |
| C. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
11.下列元素的原子在形成不同物质时,既能形成离子键,又能形成共价键的是( )
| A. | K | B. | Ca | C. | Cl | D. | Ar |
18.已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法不正确的是( )
| 元素性质 | 元素编号 | ||||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
| 原子半径(nm) | 0.073 | 0.075 | 0.152 | 0.110 | 0.099 | 0.186 | 0.143 |
| 最高正化合价 | 无 | +5 | +1 | +5 | +7 | +1 | +3 |
| 最低负化合价 | -2 | -3 | 无 | -3 | -1 | 无 | 无 |
| A. | ⑦的简单离子不是同周期元素离子半径最小的 | |
| B. | 气态氢化物的稳定性①>② | |
| C. | 气态氢化物的沸点高低②>④ | |
| D. | 阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥ |
8.某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
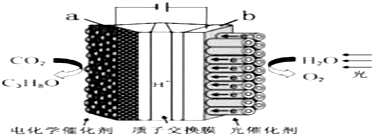

| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从b极区向a极区迁移 | |
| C. | 每生成1 mol O2,有44 g CO2被还原 | |
| D. | a电极的反应为:3CO2+16H+-18e-═C3H8O+4H2O |
15.氢有三种同位素:${\;}_{1}^{1}$H、${\;}_{1}^{2}$H和${\;}_{1}^{3}$H,它们之间存在差异的是( )
| A. | 中子数 | B. | 电子数 | C. | 原子序数 | D. | 质子数 |
13.下列各组晶体中化学键类型和晶体类型均相同的是( )
| A. | 二氧化硅和二氧化碳 | B. | 金刚石和石墨 | ||
| C. | 氯化钠和过氧化钠 | D. | 铁和铜 |