题目内容
6.下列化学用语或模型表示正确的是( )| A. | 氚原子符号:H | B. | H2O2分子结构式:H-O-O-H | ||
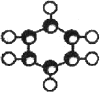
| C. | Mg2+结构示意图: | D. | HF的形成过程  |
分析 A.氚原子的中子数为2,其元素符号为T;
B.双氧水分子中含有两个O-H键和1个O-O键;
C.镁离子的核外电子总数为10,最外层含有8个电子;
D.氟化氢为共价化合物,不存在阴阳离子.
解答 解:A.H为氕原子,氚原子的中子数为3,其正确的原子符号为T,故A错误;
B.H2O2分子含有两个O-H键和1个O-O键,其结构式为:H-O-O-H,故B正确;
C. 为镁原子结构示意图,镁离子的结构示意图为:
为镁原子结构示意图,镁离子的结构示意图为: ,故C错误;
,故C错误;
D.HF是共价化合物,用电子式表示其形成过程为: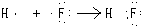 ,故D错误;
,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、离子结构示意图、元素符号、结构式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.稀氨水中存在平衡:NH3•H2O?NH4++OH_,若要使平衡逆向移动,同时使C (OH_)增大,应加入的物质或采取的措施是( )
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥MgSO4固体.
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥MgSO4固体.
| A. | ①②③⑤ | B. | ③⑥ | C. | ③ | D. | ③⑤ |
14.短周期元素W、X、Y和Z的原子序数依次增大.元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )
| A. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| B. | 元素X的单质能与其最高价氧化物反应 | |
| C. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
1.下列图示与对应的叙述相符的是( )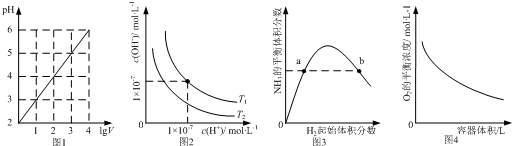

| A. | 图1表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化 | |
| B. | 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1 | |
| C. | 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点 | |
| D. | 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)?2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系 |
11.下列元素的原子在形成不同物质时,既能形成离子键,又能形成共价键的是( )
| A. | K | B. | Ca | C. | Cl | D. | Ar |
18.已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法不正确的是( )
| 元素性质 | 元素编号 | ||||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
| 原子半径(nm) | 0.073 | 0.075 | 0.152 | 0.110 | 0.099 | 0.186 | 0.143 |
| 最高正化合价 | 无 | +5 | +1 | +5 | +7 | +1 | +3 |
| 最低负化合价 | -2 | -3 | 无 | -3 | -1 | 无 | 无 |
| A. | ⑦的简单离子不是同周期元素离子半径最小的 | |
| B. | 气态氢化物的稳定性①>② | |
| C. | 气态氢化物的沸点高低②>④ | |
| D. | 阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥ |
15.氢有三种同位素:${\;}_{1}^{1}$H、${\;}_{1}^{2}$H和${\;}_{1}^{3}$H,它们之间存在差异的是( )
| A. | 中子数 | B. | 电子数 | C. | 原子序数 | D. | 质子数 |

 ;
; .
. ③能与水在一定条件下反应生成C
③能与水在一定条件下反应生成C