题目内容
19.短周期主族元素A、B、C、D的原子序数依次增大,A、B、C原子的最外层电子数之和为12,B、C、D位于同一周期,C原子的最外层电子数既是A原子内层电子数的3倍又是B原子最外层电子数的3倍.下列说法正确的是( )| A. | 原子半径:B>A,离子半径:C<D | |
| B. | B的单质能与A的最高价氧化物发生置换反应 | |
| C. | 元素B和D能形成BD2型的共价化合物 | |
| D. | D的单质有毒,且有漂白性 |
分析 C原子的最外层电子数是B原子最外层电子数的3倍,则二者的最外层电子数应为偶数,A、B、C原子的最外层电子数之和为12,则A的最外层电子数为偶数,C原子的最外层电子数既是A原子内层电子数的3倍,则C的最外层电子数为6,B的最外层电子数为2,A的最外层电子数为4,则A为C元素,B、C、D位于同一周期,应为第三周期元素,C为S元素,B为Mg元素,则D应为Cl元素,结合元素对应单质、化合物的性质解答该题.
解答 解:C原子的最外层电子数是B原子最外层电子数的3倍,则二者的最外层电子数应为偶数,A、B、C原子的最外层电子数之和为12,则A的最外层电子数为偶数,C原子的最外层电子数既是A原子内层电子数的3倍,则C的最外层电子数为6,B的最外层电子数为2,A的最外层电子数为4,则A为C元素,B、C、D位于同一周期,应为第三周期元素,C为S元素,B为Mg元素,则D应为Cl元素,
根据分析可知:A为C,B为Mg,C为S,D为Cl,
A.A为C、B为Mg,原子半径Mg>C;C为S、D为Cl,硫离子与氯离子的电子层数相同,电荷守恒越大,离子半径越小,则离子半径:C>D,故A错误;
B.根据反应:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,该反应为置换反应,故B正确;
C.B为Mg,D为Cl,二者形成的化合物为离子化合物,故C错误;
D.D为Cl,干燥的氯气没有漂白性,故D错误;
故选B.
点评 本题考查元素的位置结构性质的关系及应用,题目难度中等,推断元素为解答关键,注意根据核外电子关系特点判断元素的种类,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
10.部分弱电解质的电离平衡常数如下表,下列说法不正确的是( )
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数 (25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 由上表可知酸性HCOOH>H2CO3 | |
| B. | 0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 0.1mol/L的NaHCO3溶液中:c(H2CO3)+c(H+)=c(OH-)+c(CO32-) | |
| D. | 结合H+的能力:CO32->HCO3->CN->HCOO- |
7.甲醇是基本化工原料,甲醇及其可制得产品的沸点如下.
(1)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得二甲胺,二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-);
(2)甲醇合成二甲基甲酰胺的化学方程式为:2CH3OH+NH3+CO?(CH3)2NCHO+2H2O△H若该反应在常温下能自发进行,则该反应为放热反应(填“吸热”、“放热”).
(3)甲醇制甲醚的化学方程式为:2CH3OH?CH3OCH3+H2O△H.一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生该反应.
①x/y=$\frac{1}{2}$;
②已知387℃时该反应的化学平衡常数K=4.若起始时向容器I中充入0.1mol CH3OH、0.15mol CH3OCH3和0.10mol H2O,则此时v正>v逆(填“>”、“<”或“=”)
(4)以甲醇为主要原料,电化学合成碳酸二甲酯工作原理如图所示.
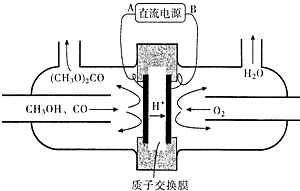
写出阳极的电极反应式2CH3OH+CO-2e-=(CH3O)2CO+2H+.
| 名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
| 结构式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH | (CH3O)2CO |
| 沸点(℃) | 64.7 | 7.4 | 153℃ | -24.9 | 90℃ |
(2)甲醇合成二甲基甲酰胺的化学方程式为:2CH3OH+NH3+CO?(CH3)2NCHO+2H2O△H若该反应在常温下能自发进行,则该反应为放热反应(填“吸热”、“放热”).
(3)甲醇制甲醚的化学方程式为:2CH3OH?CH3OCH3+H2O△H.一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生该反应.
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
②已知387℃时该反应的化学平衡常数K=4.若起始时向容器I中充入0.1mol CH3OH、0.15mol CH3OCH3和0.10mol H2O,则此时v正>v逆(填“>”、“<”或“=”)
(4)以甲醇为主要原料,电化学合成碳酸二甲酯工作原理如图所示.

写出阳极的电极反应式2CH3OH+CO-2e-=(CH3O)2CO+2H+.
14.短周期元素W、X、Y和Z的原子序数依次增大.元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )
| A. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| B. | 元素X的单质能与其最高价氧化物反应 | |
| C. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
4.下列图象正确的是( )
| A. |  反应的正方向放热(t1时升温) | |
| B. |  SO2气体通入氯水中 | |
| C. |  NaOH溶液滴加Ca(HCO3)2溶液中 | |
| D. |  将PH相同的NH4Cl溶液和稀盐酸稀释时PH的变化 |
11.下列元素的原子在形成不同物质时,既能形成离子键,又能形成共价键的是( )
| A. | K | B. | Ca | C. | Cl | D. | Ar |
8.某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
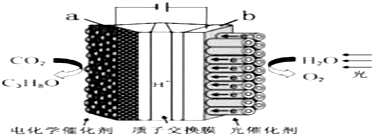

| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从b极区向a极区迁移 | |
| C. | 每生成1 mol O2,有44 g CO2被还原 | |
| D. | a电极的反应为:3CO2+16H+-18e-═C3H8O+4H2O |
 ;写出A分子中官能团的名称羧基、羟基;
;写出A分子中官能团的名称羧基、羟基;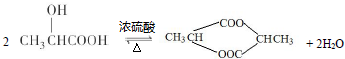 ;
;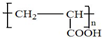 .
.