题目内容
2.已知A、B为短周期元素,它们的原子最外层电子数相同,且A的原子半径小于B,若m为正整数,则下列说法正确的是( )| A. | 若HAOm是强酸,则HBOm也一定为强酸 | |
| B. | 若B为非金属元素,则A可能为金属元素,若B为金属元素,则A可能为非金属元素 | |
| C. | 常温下,若B的简单氢化物是气体,则A的简单氢化物可能是液体 | |
| D. | 若B(OH)m是强碱,则A(OH)m也是强碱 |
分析 A、B两种短周期元素,原子半径是:r(A)<r(B),且A、B两种元素原子的最外层电子数相同,则A、B位于周期表同一主族,且B在A的下一周期,结合元素周期律的递变规律解答该题.
解答 解:A、B两种短周期元素,原子半径是:r(A)<r(B),且A、B两种元素原子的最外层电子数相同,则A、B位于周期表同一主族,且B在A的下一周期,则:
A.同主族元素从上到下元素的非金属性逐渐减弱,对应的最高价氧化物的水化物的酸性逐渐减弱,若HnAOm是强酸,则B的最高价氧化物对应的水化物不一定为强酸,故A错误;
B.同主族元素从上到下元素的金属性逐渐增强,若B为非金属元素,则A一定为非金属元素,故B错误;
C.常温下,若B元素的氢化物是气体,则A元素的氢化物可能是液体,如O、S,故C正确;
D.主族元素从上到下元素的金属性逐渐增强,则碱性:B(OH)m大于A(OH)m,若B(OH)m是强碱,A(OH)m可能为弱碱,故D错误;
故选C.
点评 本题考查了原子结构与元素周期律的应用,题目难度中等,明确元素周期律内容为解答关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系,试题培养了学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列分子中,所有原子的最外层均为8电子结构的是( )
| A. | BeCl2 | B. | H2S | C. | NCl3 | D. | BF3 |
10.部分弱电解质的电离平衡常数如下表,下列说法不正确的是( )
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数 (25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 由上表可知酸性HCOOH>H2CO3 | |
| B. | 0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 0.1mol/L的NaHCO3溶液中:c(H2CO3)+c(H+)=c(OH-)+c(CO32-) | |
| D. | 结合H+的能力:CO32->HCO3->CN->HCOO- |
7.甲醇是基本化工原料,甲醇及其可制得产品的沸点如下.
(1)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得二甲胺,二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-);
(2)甲醇合成二甲基甲酰胺的化学方程式为:2CH3OH+NH3+CO?(CH3)2NCHO+2H2O△H若该反应在常温下能自发进行,则该反应为放热反应(填“吸热”、“放热”).
(3)甲醇制甲醚的化学方程式为:2CH3OH?CH3OCH3+H2O△H.一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生该反应.
①x/y=$\frac{1}{2}$;
②已知387℃时该反应的化学平衡常数K=4.若起始时向容器I中充入0.1mol CH3OH、0.15mol CH3OCH3和0.10mol H2O,则此时v正>v逆(填“>”、“<”或“=”)
(4)以甲醇为主要原料,电化学合成碳酸二甲酯工作原理如图所示.
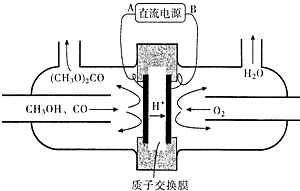
写出阳极的电极反应式2CH3OH+CO-2e-=(CH3O)2CO+2H+.
| 名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
| 结构式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH | (CH3O)2CO |
| 沸点(℃) | 64.7 | 7.4 | 153℃ | -24.9 | 90℃ |
(2)甲醇合成二甲基甲酰胺的化学方程式为:2CH3OH+NH3+CO?(CH3)2NCHO+2H2O△H若该反应在常温下能自发进行,则该反应为放热反应(填“吸热”、“放热”).
(3)甲醇制甲醚的化学方程式为:2CH3OH?CH3OCH3+H2O△H.一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生该反应.
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
②已知387℃时该反应的化学平衡常数K=4.若起始时向容器I中充入0.1mol CH3OH、0.15mol CH3OCH3和0.10mol H2O,则此时v正>v逆(填“>”、“<”或“=”)
(4)以甲醇为主要原料,电化学合成碳酸二甲酯工作原理如图所示.

写出阳极的电极反应式2CH3OH+CO-2e-=(CH3O)2CO+2H+.
14.短周期元素W、X、Y和Z的原子序数依次增大.元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )
| A. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| B. | 元素X的单质能与其最高价氧化物反应 | |
| C. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
11.下列元素的原子在形成不同物质时,既能形成离子键,又能形成共价键的是( )
| A. | K | B. | Ca | C. | Cl | D. | Ar |
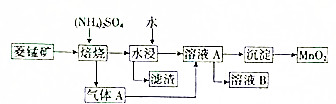 锰是重要的金属元素,制备单质锰的方法之一是先获得高纯度的二氧化锰,然后用还原剂还原MnO2,从低品位的菱锰矿(主要成分是MnCO3)中获得高纯度的MnO2的流程图如下(已知常温下MnCO3的Ksp=9×10-11;离子浓度小于1.0×10-5mol•L-时,即可认为该离子沉淀完全):
锰是重要的金属元素,制备单质锰的方法之一是先获得高纯度的二氧化锰,然后用还原剂还原MnO2,从低品位的菱锰矿(主要成分是MnCO3)中获得高纯度的MnO2的流程图如下(已知常温下MnCO3的Ksp=9×10-11;离子浓度小于1.0×10-5mol•L-时,即可认为该离子沉淀完全):
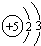 ;
;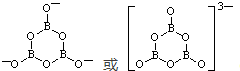 .
.