题目内容
1.某研究小组为了探究固体甲(二元化合物)和固体乙(无机矿物盐,含五种元素)的组成和性质,设计并完成了如下实验:
已知:向溶液1中连续滴加盐酸,先产生白色沉淀,后沉淀溶解;向溶液2中连续通入气体2,也是先产生白色沉淀,后沉淀溶解.请回答下列问题:
(1)甲的化学式是Al4C3,气体1分子的空间构型是正四面体.
(2)乙的化学式是BaCO3•Cu(OH)2或BaCu(OH)2CO3.
(3)加热条件下,气体1与固体2反应,可产生另外一种气体和一种固体,该反应的化学方程式为4CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$4Cu+CO2+2H2O或8CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$4Cu2O+CO2+2H2O或3CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+CO+2H2O或6CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$3Cu2O+CO+2H2O.
(4)足量气体2与溶液1反应的离子方程式为CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-.有人认为,判断该反应的气体2是否过量较难,应对其中一种产物是“正盐”还是“酸式盐”进行检验,请设计实验证明这一产物的成分:取反应后的溶液少许于试管中,滴加过量的CaCl2溶液,若出现白色沉淀,则产物中有正盐;过滤后,向滤液中滴加NaOH溶液,若又出现白色沉淀,则产物中有酸式盐.若二者都出现,为二者混合物(可选的试剂为:氨水、NaOH溶液、稀硫酸、CaCl2溶液).
分析 含氢量最高的烃为CH4,则甲为碳化物,溶液1为钠盐溶液,向溶液1中连续滴加盐酸,先产生白色沉淀,后沉淀溶解,说明应含有Al元素,溶液1为NaAlO2,气体2为CO2,沉淀b为Al(OH)3,则甲为Al4C3,乙加热生成液体a为H2O,固体2加入盐酸溶液变为蓝色,应生成氯化铜,固体2为CuO,固体1应为氧化物,溶液2中连续通入二氧化碳,也是先产生白色沉淀,后沉淀溶解,说明固体1含有BaO,且m(BaO)=23.3g-8g=15.3g,n(BaO)=$\frac{15.3g}{153g/mol}$=0.1mol,n(CuO)=$\frac{8g}{80g/mol}$=0.1mol,乙含有Cu、Ba、H、C、O元素,为BaCO3•Cu(OH)2或BaCu(OH)2CO3,以此解答该题.
解答 解:含氢量最高的烃为CH4,则甲为碳化物,溶液1为钠盐溶液,向溶液1中连续滴加盐酸,先产生白色沉淀,后沉淀溶解,说明应含有Al元素,溶液1为NaAlO2,气体2为CO2,沉淀b为Al(OH)3,则甲为Al4C3,乙加热生成液体a为H2O,固体2加入盐酸溶液变为蓝色,应生成氯化铜,固体2为CuO,固体1应为氧化物,溶液2中连续通入二氧化碳,也是先产生白色沉淀,后沉淀溶解,说明固体1含有BaO,且m(BaO)=23.3g-8g=15.3g,n(BaO)=$\frac{15.3g}{153g/mol}$=0.1mol,n(CuO)=$\frac{8g}{80g/mol}$=0.1mol,乙含有Cu、Ba、H、C、O元素,为BaCO3•Cu(OH)2或BaCu(OH)2CO3,
(1)由以上分析可知甲为Al4C3,气体1为甲烷,分子的空间构型是正四面体,故答案为:Al4C3;正四面体;
(2)乙含有Cu、Ba、H、C、O元素,为BaCO3•Cu(OH)2或BaCu(OH)2CO3,故答案为:BaCO3•Cu(OH)2或BaCu(OH)2CO3;
(3)加热条件下,甲烷与氧化铜反应,可产生另外一种气体和一种固体,该反应的化学方程式为4CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$ 4Cu+CO2+2H2O或8CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$ 4Cu2O+CO2+2H2O或3CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+CO+2H2O 或 6CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu2O+CO+2H2O,
故答案为:4CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$ 4Cu+CO2+2H2O或8CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$ 4Cu2O+CO2+2H2O或3CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+CO+2H2O 或 6CuO+CH4$\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu2O+CO+2H2O;
(4)足量气体2与溶液1反应的离子方程式为CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,检验产物是“正盐”还是“酸式盐”,可取反应后的溶液少许于试管中,滴加过量的CaCl2溶液,若出现白色沉淀,则产物中有正盐;过滤后,向滤液中滴加NaOH溶液,若又出现白色沉淀,则产物中有酸式盐.若二者都出现,为二者混合物,
故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;取反应后的溶液少许于试管中,滴加过量的CaCl2溶液,若出现白色沉淀,则产物中有正盐;过滤后,向滤液中滴加NaOH溶液,若又出现白色沉淀,则产物中有酸式盐.若二者都出现,为二者混合物.
点评 本题考查物质成分确定,为高频考点,侧重考查学生分析推断能力,明确物质颜色、性质是解本题关键,难点是实验方案设计,要根据物质性质结合实验目的确定实验设计,同时考查学生思维缜密性、实验操作及实验设计能力,题目难度中等.

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案| A. | 溶液的碱性太弱 | B. | Al3+不与氨水反应 | ||
| C. | 生成的Al(OH)3溶解了 | D. | Al3+几乎都与F-结合生成了新物质 |
| A. | 少量过氧化钠投入AlCl3溶液 | B. | FeCl3溶液与NaHCO3溶液混合加热 | ||
| C. | Ba(OH)2溶液与(NH4)2SO4 | D. | 明矾溶液与小苏打溶液混合 |
| A. | 原子半径为次序为W>Y>Z | B. | Y、W形成的化合物水溶液显碱性 | ||
| C. | 对应氢化物的稳定性:Y>Z | D. | W与X、Y、Z均能形成离子化合物 |
| A. | 酒香四溢 | B. | 海带制碘 | C. | 石油分馏 | D. | 萃取分液 |
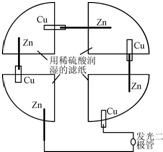 将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )
将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )| A. | 锌片上有气泡,铜片溶解 | B. | Zn都是负极,发生还原反应 | ||
| C. | 电子都是从铜片经外电路流向锌片 | D. | 该装置至少有两种形式的能量转换 |

 .
. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O
+H2O