题目内容
10.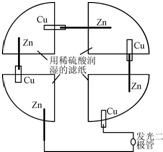 将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )
将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )| A. | 锌片上有气泡,铜片溶解 | B. | Zn都是负极,发生还原反应 | ||
| C. | 电子都是从铜片经外电路流向锌片 | D. | 该装置至少有两种形式的能量转换 |
分析 为四个原电池的串联电路,其中Zn为负极,被氧化,Cu为正极,原电池工作时,电子从负极经外电路流向正极,以此解答该题.
解答 解:A.锌为负极,铜为正极,正极上生成氢气,故A错误;
B.锌为负极,发生氧化反应,故B错误;
C.,电子从锌极经外电路流向铜极,故C错误;
D.该装置存在电能、化学能与电能与光能的转化,故D正确.
故选D.
点评 本题考查原电池的工作原理,为高频考点,题目难度不大,本题注意把握原电池正负极的判断以及电子、电流的流向.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
8.高能糖电池是一种新型的电池,该电池解决了环境污染问题,有望在未来代替传统电池.该电池的工作原理为C6H12O6(葡萄糖)+6O2═6CO2+6H2O,下列有关说法正确的是( )
| A. | 该电池的工作环境应在高温条件下 | |
| B. | 正极反应:O2+4H++4e-═2H2O | |
| C. | 电池工作时葡萄糖在负极上失去电子发生还原反应 | |
| D. | 电池工作时H+由负极移向正极,但电解液的pH不变 |
18.反应C+H2O$\stackrel{高温}{?}$CO+H2在密闭容器中进行.下列关于该反应的说法不正确的是( )
| A. | 降低温度能减慢反应速率 | |
| B. | 单质碳的颗粒变小能加快反应速率 | |
| C. | 增大H2O蒸气的浓度能加快反应速率 | |
| D. | 加入足量的C能使H2O反应完全 |
5.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 1 mol Mg转变为Mg2+失去的电子数目为NA | |
| B. | 常温常压下,22.4 L O2含有的分子数目为NA | |
| C. | 1 mol•L-1KOH溶液中含有的钾离子数目为NA | |
| D. | 标准状况下,22.4 L CO2、CO的混合气中含有的碳原子数目为NA |
15.下列叙述正确的是( )
| A. | 工业上利用电解法冶炼铝和铁 | |
| B. | 生产和生活中常用可溶性铝盐和铜盐净水 | |
| C. | 工业合成氨的反应属于能自发进行的反应,故能迅速发生 | |
| D. | 热的纯碱溶液清洗带油污的餐具与盐类和酯类的水解均有关 |
2.下列各物质中,一定是同系物的是( )
| A. | C3H6和2-甲基1-丁烯 | |
| B. | 3,3-二甲基-1-丁炔和3-甲基1-戊炔 | |
| C. |  和 和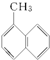 | |
| D. | C4H10和C9H20 |
19.X、Y、Z、W为短周期主族元素,X原子M层有1个电子,Y原子最外层电子数为最内层电子数的2倍,Z元素的最高化合价为最低化合价绝对值的3倍,Z、W同周期,W的原子半径小于Z.下列叙述正确的是( )
| A. | 原子半径由大到小的顺序:Z、X、Y | |
| B. | 元素非金属性由强到弱的顺序:W、Z、Y | |
| C. | 简单气态氢化物的稳定性由强到弱的顺序:Z、W | |
| D. | W分别与X、Y形成的化合物化学键类型相同 |
20.在pH=1的无色透明溶液中能大量共存的离子组是( )
| A. | Al3+ Ag+ NO3- Cl- | B. | Mg2+NH4+ NO3- I- | ||
| C. | Ba2+K+ S2- Cl- | D. | Zn2+ Na+ NO3- SO42- |
