题目内容
20.苯和溴取代反应的实验装置如图所示,其中A为由具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉.填写下列空白: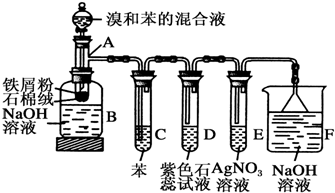
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒内就发生反应.写出A中所发生反应的化学方程式(有机物写结构简式):
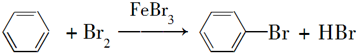 .
.(2)B中NaOH溶液的作用是除去溶于溴苯中的溴.
(3)试管C中苯的作用是除去HBr气体中混有的溴蒸气.
反应开始后,观察D和E两试管,看到的现象为D试管中紫色石蕊试液慢慢变红,并在导管口有白雾产生,然后E试管中出现浅黄色沉淀,此现象可以验证苯和液溴的反应为取代反应(填反应类型).
分析 (1)苯与溴在溴化铁做催化剂条件下发生取代反应生成溴苯和溴化氢;
(2)溴单质易溶于溴苯,可以用氢氧化钠溶液洗涤除去;
(3)溴易挥发,易溶于有机溶剂,溴能够对溴化氢检验造成干扰;溴化氢溶于水电离产生氢离子和氯离子,据此分析解答.
解答 解:(1)A中所发生反应为:苯与溴在溴化铁做催化剂条件下发生取代反应生成溴苯和溴化氢,化学方程式: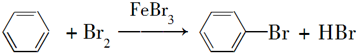 ;
;
故答案为: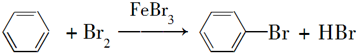 ;
;
(2)B中的NaOH溶液作用是吸收反应生成的溴苯中溶解的溴单质,
故答案为:除去溶于溴苯中的溴;
(3)溴易挥发,易溶于有机溶剂,所以用C来吸收吸收溴化氢中的溴和挥发的有机物蒸汽,防止对溴化氢的检验造成干扰;溴化氢溶于水电离产生氢离子和氯离子,所以溶液显酸性,能使石蕊变红色,并在导管口有白雾产生,硝酸银中的银离子与溴离子反应生成淡黄色的沉淀,所以D试管中紫色石蕊试液慢慢变红,并在导管口有白雾产生,然后E试管中出现浅黄色沉淀,此现象可以验证苯和液溴的反应生成溴化氢为取代反应,
故答案为:除去HBr气体中混有的溴蒸气;D试管中紫色石蕊试液慢慢变红,并在导管口有白雾产生,然后E试管中出现浅黄色沉淀;取代反应.
点评 本题考查了苯的取代反应实验,考查的知识点有反应方程式的书写、产物的判断、试剂作用及性质,明确苯的结构及与溴发生反应及产物性质是解题关键,题目难度中等.

练习册系列答案
相关题目
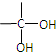
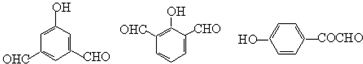
10.A、B是相对分子质量不相等的两种有机物,无论A、B以何种比例混合,只要混合物总质量不变,完全燃烧后,产生水的质量也不变.下列各种化合物中符合这种条件的是( )
| A. | 乙酸和甲酸甲酯 | B. | 乙烷和乙醛 | ||
| C. | 甲醛和麦芽糖(C12H22O11) | D. | 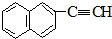 和 和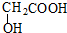 |
8.下列属于化学变化的是( )
| A. | 冰雪融化 | B. | 纸张燃烧 | C. | 水分蒸发 | D. | 矿石粉碎 |
15.高锰酸钾是中学化学常用的强氧化剂,实验室中可通过以下反应制得:
MnO2熔融氧化:3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
已知K2MnO4溶液显绿色,KMnO4溶液显紫红色.实验流程如下:

请回答:
(1)步骤①应在D中熔化,并用铁棒用力搅拌,以防结块.
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是B.
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低.
③下列监控K2MnO4歧化完全的方法或操作可行的是B.
A.通过观察溶液颜色变化,若溶液颜色由绿色完全变成紫红色,表明反应已歧化完全
B.取上层清液少许于试管中,继续通入CO2,若无沉淀产生,表明反应已歧化完全
C.取上层清液少许于试管中,加入还原剂如亚硫酸钠溶液,若溶液紫红色褪去,表明反应已歧化完全
D.用pH试纸测定溶液的pH值,对照标准比色卡,若pH为10~11,表明反应已歧化完全
(3)烘干时,温度控制在80℃为宜,理由是温度过高,产品受热分解,温度过低,烘干时间长.
(4)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数).
①实验时先将草酸晶体(H2C2O4•2H2O)配成标准溶液,实验室常用的容量瓶规格有100mL、250mL等多种,现配制90mL 1.5mol•L-1的草酸溶液,需要称取草酸晶体的质量为18.9g.
②量取KMnO4溶液应选用酸式(填“酸式”或“碱式”)滴定管,若该滴定管用蒸馏水洗净后未润洗,则最终测定结果将偏小(填“偏大”、“偏小”或“不变”).
MnO2熔融氧化:3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |

请回答:
(1)步骤①应在D中熔化,并用铁棒用力搅拌,以防结块.
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是B.
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低.
③下列监控K2MnO4歧化完全的方法或操作可行的是B.
A.通过观察溶液颜色变化,若溶液颜色由绿色完全变成紫红色,表明反应已歧化完全
B.取上层清液少许于试管中,继续通入CO2,若无沉淀产生,表明反应已歧化完全
C.取上层清液少许于试管中,加入还原剂如亚硫酸钠溶液,若溶液紫红色褪去,表明反应已歧化完全
D.用pH试纸测定溶液的pH值,对照标准比色卡,若pH为10~11,表明反应已歧化完全
(3)烘干时,温度控制在80℃为宜,理由是温度过高,产品受热分解,温度过低,烘干时间长.
(4)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数).
①实验时先将草酸晶体(H2C2O4•2H2O)配成标准溶液,实验室常用的容量瓶规格有100mL、250mL等多种,现配制90mL 1.5mol•L-1的草酸溶液,需要称取草酸晶体的质量为18.9g.
②量取KMnO4溶液应选用酸式(填“酸式”或“碱式”)滴定管,若该滴定管用蒸馏水洗净后未润洗,则最终测定结果将偏小(填“偏大”、“偏小”或“不变”).




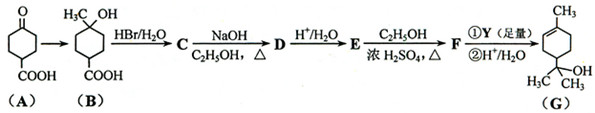
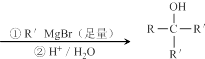
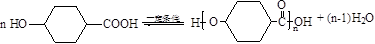 .
.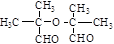 .
.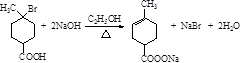 .
.
 $\stackrel{自动脱水}{→}$
$\stackrel{自动脱水}{→}$
 .
. .
.