题目内容
8.下列属于化学变化的是( )| A. | 冰雪融化 | B. | 纸张燃烧 | C. | 水分蒸发 | D. | 矿石粉碎 |
分析 物理变化过程中没有新物质生成,化学变化过程中有新物质生成,据此分析解答.
解答 解:A.冰雪融化是水的固态与液态之间转化,没有新物质生成,属于物理变化,故A不选;
B.纸张燃烧生成二氧化碳,有新物质生成,属于化学变化,故B选;
C.水分蒸发为水的气态与液态之间转化,属于物理变化,故C不选;
D.矿石粉碎属于物质形状变化,没有新物质生成,属于物理变化,故D不选;
故选:B.
点评 本题考查了物理变化与化学变化的判断,明确是否有新物质生成是解题关键,题目难度不大.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
18.下列说法中不正确的是( )
| A. | 对氯甲苯、1,2-二氯乙烷、3-甲基-1-丁烯的结构简式分别为: 、CH2Cl-CH2Cl、 、CH2Cl-CH2Cl、 | |
| B. | 2,3,4一三甲基戊烷的核磁共振氢谱中出现四组峰 | |
| C. | 3,4一二甲基己烷的一氯代产物有4种 | |
| D. | 甲苯、硝基苯、2-甲基丙烯分子中的所有碳原子处于同一平面上 |
3.将铁片放入下列足量的溶液中,使溶液质量增加的是( )
| A. | H2SO4(稀) | B. | CuSO4 | C. | FeCl3 | D. | FeCl2 |
13.下列化学方程式书写正确的是( )
| A. | 2P+5O2$\frac{\underline{\;点燃\;}}{\;}$P2O5 | B. | Fe2O3+3CO═2Fe+3CO2 | ||
| C. | H2O2$\frac{\underline{\;MnO_2\;}}{\;}$H2↑+O2↑ | D. | NaHCO3+HCl═NaCl+H2O+CO2↑ |
17.硫酸锌被广泛应用于医药领域和工农业生产.工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4•7H2O的一种流程如图:
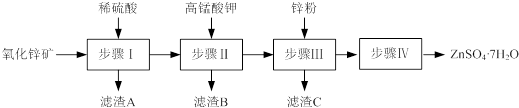
(1)步骤Ⅰ的操作是过滤,滤渣A的主要成分是H2SiO3.
(2)步骤Ⅰ加入稀硫酸进行酸浸时,需不断通入高温水蒸气的目的是H2SiO3+2NaOH=Na2SiO3+2H2O.
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为3Fe2++MnO4-+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+.
(4)步骤Ⅲ中,加入锌粉的作用是换出Cu,除去Cu2+.所得的滤液中含有的金属阳离子有Zn2+、K+.
(5)已知硫酸锌的溶解度与温度之间的关系如下表:
从硫酸锌溶液中获得硫酸锌晶体的实验操作为60℃条件下蒸发浓缩、降温结晶、过滤.
烘干操作需在减压低温条件下进行,原因是降低烘干的温度,防止ZnSO4•7H2O分解.
(6)取28.70g ZnSO4•7H2O加热至不同温度,剩余固体的质量变化如图所示.
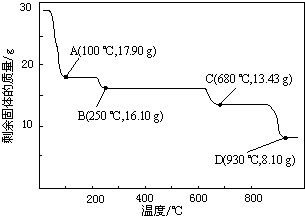
分析数据,680℃时所得固体的化学式为b.
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4•H2O.

(1)步骤Ⅰ的操作是过滤,滤渣A的主要成分是H2SiO3.
(2)步骤Ⅰ加入稀硫酸进行酸浸时,需不断通入高温水蒸气的目的是H2SiO3+2NaOH=Na2SiO3+2H2O.
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为3Fe2++MnO4-+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+.
(4)步骤Ⅲ中,加入锌粉的作用是换出Cu,除去Cu2+.所得的滤液中含有的金属阳离子有Zn2+、K+.
(5)已知硫酸锌的溶解度与温度之间的关系如下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
烘干操作需在减压低温条件下进行,原因是降低烘干的温度,防止ZnSO4•7H2O分解.
(6)取28.70g ZnSO4•7H2O加热至不同温度,剩余固体的质量变化如图所示.

分析数据,680℃时所得固体的化学式为b.
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4•H2O.
18.下列各组晶体物质中,化学键类型相同,晶体类型也相同的是( )
①SO2和SiO2②晶体硼和HCl③CO2和SO2④晶体硅和金刚石③晶体氖和晶体氮③硫黄和碘.
①SO2和SiO2②晶体硼和HCl③CO2和SO2④晶体硅和金刚石③晶体氖和晶体氮③硫黄和碘.
| A. | ①②③ | B. | ④⑤⑥ | C. | ③④⑥ | D. | ①③⑤ |
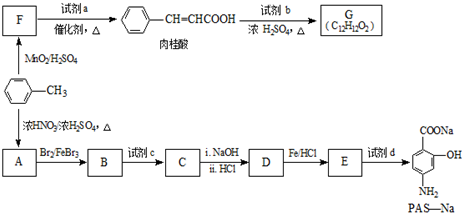
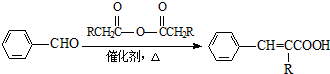 (R=-CH3或-H)
(R=-CH3或-H)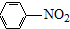 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$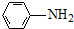
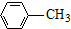 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$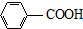
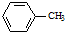 生成A的反应类型是取代反应或硝化反应.
生成A的反应类型是取代反应或硝化反应.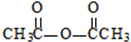 .
.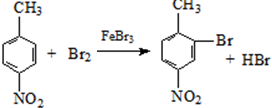 .
.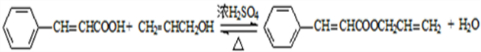 .
.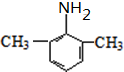 (写出其中一种结构简式).
(写出其中一种结构简式).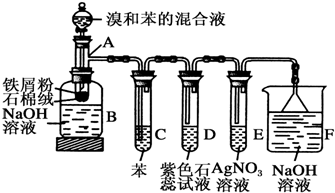
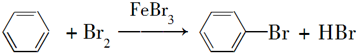 .
.