题目内容
12.有机物W~H 有如下的转化关系.已知W、B为芳香族化合物,X为卤素原子,W、A、B均能与NaHCO3溶液反应,A分子中有2个甲基,H分子中含有醛基且苯环上的取代基处于对位
已知:
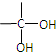 $\stackrel{自动脱水}{→}$
$\stackrel{自动脱水}{→}$
请回答下列有关问题:
(1)反应①、②分别属于水解(或取代)反应、消去反应(填有机反应类型),A、B中均含有的含氧官能团的名称是羧基.
(2)F的化学式AgBr,B的结构简式
 .
.(3)反应②的化学方程式是(CH3)2CBrCOOH+2NaOH$→_{△}^{醇}$CH2=C(CH3)COONa+NaBr+2H2O.
(4)若D$→_{浓H_{2}SO_{4}/△}^{醇}$L$\stackrel{催化剂}{→}$有机玻璃【(C5H8O2)n】,则反应④的化学方程式是CH2=C(CH3)COOH+CH3OH$→_{△}^{浓硫酸}$CH2=C(CH3)COOCH3+H2O.
(5)H有多种同分异构体,且满足下列3个条件
(i) 遇FeCl3显紫色 (ii)苯环上一取代物有两种 (ⅲ)除苯环外无其它环状结构试写出三种符合条件的同分异构体的结构简式
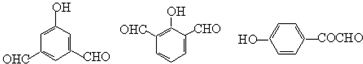 .
.
分析 W、A、B均能与NaHCO3溶液反应,均含有羧基,W在酸性条件下水解得到A与B,W中含有酯基,A发生消去反应、B发生水解反应均得到E,E与硝酸银反应得到淡黄色沉淀,故X为Br元素,E为NaBr,F为AgBr.A、B分子中均含有Br原子,B在氢氧化钠水溶液、加热条件下发生水解反应得到G,G酸化得到H,H分子中含有醛基且苯环上的取代基处于对位,则H为 ,结合碳原子碳原子连接2个羟基不稳定,自动转化为羰基,可推知B为
,结合碳原子碳原子连接2个羟基不稳定,自动转化为羰基,可推知B为 ,则G为
,则G为 .A在氢氧化钠醇溶液、加热条件下发生消去反应得到C,C酸化得到D,A分子中有2个甲基,结合D的分子式可知,A为(CH3)2CBrCOOH,则C为CH2=C(CH3)COONa,D为CH2=C(CH3)COOH,综上分析可知X为
.A在氢氧化钠醇溶液、加热条件下发生消去反应得到C,C酸化得到D,A分子中有2个甲基,结合D的分子式可知,A为(CH3)2CBrCOOH,则C为CH2=C(CH3)COONa,D为CH2=C(CH3)COOH,综上分析可知X为 ,据此分析解答.
,据此分析解答.
解答 解:W、A、B均能与NaHCO3溶液反应,均含有羧基,W在酸性条件下水解得到A与B,W中含有酯基,A发生消去反应、B发生水解反应均得到E,E与硝酸银反应得到淡黄色沉淀,故X为Br元素,E为NaBr,F为AgBr.A、B分子中均含有Br原子,B在氢氧化钠水溶液、加热条件下发生水解反应得到G,G酸化得到H,H分子中含有醛基且苯环上的取代基处于对位,则H为 ,结合碳原子碳原子连接2个羟基不稳定,自动转化为羰基,可推知B为
,结合碳原子碳原子连接2个羟基不稳定,自动转化为羰基,可推知B为 ,则G为
,则G为 .A在氢氧化钠醇溶液、加热条件下发生消去反应得到C,C酸化得到D,A分子中有2个甲基,结合D的分子式可知,A为(CH3)2CBrCOOH,则C为CH2=C(CH3)COONa,D为CH2=C(CH3)COOH,综上分析可知X为
.A在氢氧化钠醇溶液、加热条件下发生消去反应得到C,C酸化得到D,A分子中有2个甲基,结合D的分子式可知,A为(CH3)2CBrCOOH,则C为CH2=C(CH3)COONa,D为CH2=C(CH3)COOH,综上分析可知X为 ,
,
(1)反应①属于水解反应或取代反应,②属于消去反应,A、B中均含有的含氧官能团的名称是:羧基,
故答案为:水解(或取代);消去;羧基;
(2)由以上分析可知F的化学式为AgBr,B的结构简式为 ,
,
故答案为:AgBr; ;
;
(3)该反应方程式为:(CH3)2CBrCOOH+2NaOH$→_{△}^{醇}$CH2=C(CH3)COONa+NaBr+2H2O,故答案为:(CH3)2CBrCOOH+2NaOH$→_{△}^{醇}$CH2=C(CH3)COONa+NaBr+2H2O;
(4)若 ,由有机玻璃的分子式可知,D与甲醇发生酯化反应生成L,反应④的化学方程式是:CH2=C(CH3)COOH+CH3OH$→_{△}^{浓硫酸}$CH2=C(CH3)COOCH3+H2O,
,由有机玻璃的分子式可知,D与甲醇发生酯化反应生成L,反应④的化学方程式是:CH2=C(CH3)COOH+CH3OH$→_{△}^{浓硫酸}$CH2=C(CH3)COOCH3+H2O,
故答案为:CH2=C(CH3)COOH+CH3OH$→_{△}^{浓硫酸}$CH2=C(CH3)COOCH3+H2O;
(5)H为 ,H结构简式符合下列条件:(i) 遇FeCl3显紫色说明含有酚羟基;
,H结构简式符合下列条件:(i) 遇FeCl3显紫色说明含有酚羟基;
(ii)苯环上一取代物有两种,说明苯环上有两种氢原子;
(ⅲ)除苯环外无其它环状结构,
则符合条件的同分异构体的结构简式有 ,
,
故答案为: .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,根据反应条件及物质的性质判断含有的官能团,利用逆推法、正推法相结合进行推断,难点是同分异构体种类判断,题目难度中等.

| A. | Cu与FeCl3溶液反应:3Cu+2Fe3+═2Fe+3Cu2+ | |
| B. | 铁与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | Na与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 向AlCl3溶液中滴入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ |
| A. | H2SO4(稀) | B. | CuSO4 | C. | FeCl3 | D. | FeCl2 |
| 阳离子 | K+、Na+、Fe2+、Ba2+、NH4+、Ca2+ |
| 阴离子 | OH-、NO3-、I-、HCO3-、AlO2-、HSO4- |
①B的化学式为Ba(OH)2.
②A、B溶液混合加热反应的离子方程式H++SO42-+NH4++Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$BaSO4↓+NH3↑+2H2O.
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色.向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化.则
①A的化学式为FeI2.
②经分析上述过程中溶液变黄的原因可能有两种(用离子方程式表示)
Ⅰ8H++2NO3-+6I-=2NO↑+3I2+4H2O;Ⅱ8H++2NO3-+6I-=2NO↑+3I2+4H2O和4H++NO3-+3Fe2+=NO↑+3Fe3++2H2O.
③请用一简易方法证明上述溶液变黄的原因取少量变黄溶液于试管中,滴加几滴KSCN溶液,若变红则Ⅱ合理(其他合理亦可).
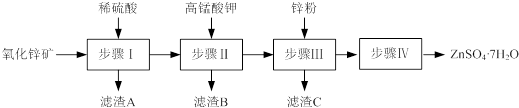
(1)步骤Ⅰ的操作是过滤,滤渣A的主要成分是H2SiO3.
(2)步骤Ⅰ加入稀硫酸进行酸浸时,需不断通入高温水蒸气的目的是H2SiO3+2NaOH=Na2SiO3+2H2O.
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为3Fe2++MnO4-+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+.
(4)步骤Ⅲ中,加入锌粉的作用是换出Cu,除去Cu2+.所得的滤液中含有的金属阳离子有Zn2+、K+.
(5)已知硫酸锌的溶解度与温度之间的关系如下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
烘干操作需在减压低温条件下进行,原因是降低烘干的温度,防止ZnSO4•7H2O分解.
(6)取28.70g ZnSO4•7H2O加热至不同温度,剩余固体的质量变化如图所示.
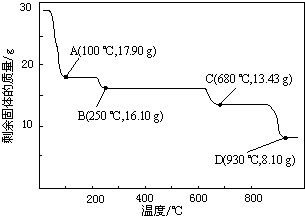
分析数据,680℃时所得固体的化学式为b.
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4•H2O.
| A. | 分子中的碳原子在一条直线上 | B. | 其一氯代物只有一种 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 结构简式为CH3 CH2 CH3 |
| A. | 实验室利用熟石灰和氯化铵共热制取氨气:NH4++OH--$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 用食醋浸泡热水瓶中的水垢(CaCO3):CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 用惰性电极电解饱和MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| D. | 向Na2SO3溶液中滴加足量NaClO溶液:SO32-+ClO-═SO42-+Cl- |

 .
.