题目内容
10.下列实验报告记录的实验现象正确的是( )| 实验 |  | ||||
| 记录 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 红色 | 无色 | 无色溶液 | 白色沉淀 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
分析 二氧化硫和水反应生成亚硫酸,亚硫酸电离出氢离子而使溶液呈酸性,石蕊试液遇酸变红色;
二氧化硫具有漂白性,能使品红溶液褪色;
二氧化硫具有还原性,溶于水生成亚硫酸,氢离子和硝酸根离子形成硝酸,二氧化硫能被硝酸溶液氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀;
二氧化硫和碱反应生成亚硫酸根离子,亚硫酸根离子和钡离子反应生成亚硫酸钡沉淀.
解答 解:二氧化硫和水反应生成亚硫酸,亚硫酸电离出氢离子而使溶液呈酸性,石蕊试液遇酸变红色,所以a中试液变红色但不褪色;
二氧化硫能和品红溶液反应生成无色物质而具有漂白性,所以看到的现象是能使品红溶液褪色;
二氧化硫具有还原性,溶于水生成亚硫酸,氢离子和硝酸根离子形成硝酸,二氧化硫能被硝酸氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀,所以看到的现象是产生白色沉淀;
二氧化硫和碱反应生成亚硫酸根离子,亚硫酸根离子和钡离子反应生成亚硫酸钡沉淀,所以看到的现象是产生白色沉淀,
故选B.
点评 本题考查了元素化合物,明确二氧化硫为酸性氧化物,具有漂白性、还原性的性质是解题关键,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
1.下列离子方程式书写正确的是( )
| A. | 实验室利用熟石灰和氯化铵共热制取氨气:NH4++OH--$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 用食醋浸泡热水瓶中的水垢(CaCO3):CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 用惰性电极电解饱和MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| D. | 向Na2SO3溶液中滴加足量NaClO溶液:SO32-+ClO-═SO42-+Cl- |
18.下列各组晶体物质中,化学键类型相同,晶体类型也相同的是( )
①SO2和SiO2②晶体硼和HCl③CO2和SO2④晶体硅和金刚石③晶体氖和晶体氮③硫黄和碘.
①SO2和SiO2②晶体硼和HCl③CO2和SO2④晶体硅和金刚石③晶体氖和晶体氮③硫黄和碘.
| A. | ①②③ | B. | ④⑤⑥ | C. | ③④⑥ | D. | ①③⑤ |
5.设NA为阿伏伽德罗常数,下列关于1L 0.2mol•L-1的Mg(NO3)2溶液的说法不正确的是( )
| A. | 2L溶液中阴、阳离子总数为1.2NA | |
| B. | 100mL溶液中NO3-物质的量为为0.4mol | |
| C. | 200mL溶液中Mg2+浓度为0.2mol•L-1 | |
| D. | 500mL溶液中NO3-总数为0.2NA |
4.在指定环境中,下列各组离子一定可以大量共存的是( )
| A. | 使pH试纸呈红色的溶液中:I-、NO3-、SO42-、Na+ | |
| B. | 水电离出的c(H+)=1×10-13mol/L的溶液中:CO32-、K+、ClO-、SO32- | |
| C. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1012的溶液中:NH4+、Ca2+、C1-、K+ | |
| D. | 加入铝粉能产生大量氢气的溶液中:NH4+、Na+、NO3-、SO42- |
8.既可以发生消去反应,且催化氧化的产物能发生银镜反应的物质是( )
| A. | 2-甲基-2-丁醇 | B. | 2,2-二甲基-1-丁醇 | ||
| C. | 2-甲基-1-丁醇 | D. | 2,3-二甲基-2-丁醇 |
9.将7mLNO2和NO的混和气体通过足量的饱和NaHCO3溶液和浓硫酸后,再通过足量Na2O2,后气体体积变为3.5mL.则原混和气体中NO2和NO的体积比为( )
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | ≧3:1的任意比 |
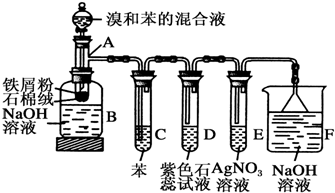
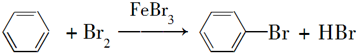 .
.