题目内容
10.A、B是相对分子质量不相等的两种有机物,无论A、B以何种比例混合,只要混合物总质量不变,完全燃烧后,产生水的质量也不变.下列各种化合物中符合这种条件的是( )| A. | 乙酸和甲酸甲酯 | B. | 乙烷和乙醛 | ||
| C. | 甲醛和麦芽糖(C12H22O11) | D. | 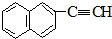 和 和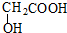 |
分析 无论以何种比例混合,只要混合物的总质量一定,完全燃烧生成水的质量也一定,两种有机物的相对分子质量不等,应满足混合物各组分分子中含H量相等或两种有机物的最简式相同,以此解答该题.
解答 解:无论以何种比例混合,只要混合物的总质量一定,完全燃烧生成水的质量也一定,说明混合物各组分分子中含H量相等,
A.乙酸和甲酸甲酯的分子式都是C2H4O2,二者的相对分子质量相等,不符合条件,故A不选;
B.乙烷和乙醛的相对分子质量分别为30、44,H原子数分别为6、4,则含氢量不同,等质量时生成水的质量不同,故B不选;
C.甲醛和麦芽糖最简式不同,含氢量不同,则等质量时生成水的质量不同,故C不选;
D. 和
和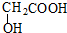 的相对分子质量不同,含氢量分别为$\frac{8}{152}$、$\frac{4}{76}$,分子中含H量相等,则无论A、B以何种比例混合,只要混合物总质量不变,完全燃烧后,产生水的质量也不变,故D选.
的相对分子质量不同,含氢量分别为$\frac{8}{152}$、$\frac{4}{76}$,分子中含H量相等,则无论A、B以何种比例混合,只要混合物总质量不变,完全燃烧后,产生水的质量也不变,故D选.
故选D.
点评 本题考查有机物燃烧的有关计算,侧重考查学生的分析、计算能力,题目难度中等,注意明确只要总质量一定,完全燃烧时生成水的质量也一定,则说明混合物各组分的分子中含H量相等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.在2L的密闭容器中发生反应:3A(g)+2B(g)?C(g)+4D(g),反应进行10s后,B减少了0.6mol,则在10s内,该反应的平均反应速率表示正确的是( )
| A. | v(A)=0.09mol•L-1•s-1 | B. | v(B)=0.06mol•L-1•s-1 | ||
| C. | v(C)=0.9mol•L-1•min-1 | D. | v(D)=3.6mol•L-1•min-1 |
18.下列说法中不正确的是( )
| A. | 对氯甲苯、1,2-二氯乙烷、3-甲基-1-丁烯的结构简式分别为: 、CH2Cl-CH2Cl、 、CH2Cl-CH2Cl、 | |
| B. | 2,3,4一三甲基戊烷的核磁共振氢谱中出现四组峰 | |
| C. | 3,4一二甲基己烷的一氯代产物有4种 | |
| D. | 甲苯、硝基苯、2-甲基丙烯分子中的所有碳原子处于同一平面上 |
15.某元素最高正价氧化物对应的水化物的化学式是HnXOm,该元素在气态氢化物中的化合价为( )
| A. | n-2m | B. | 2m-n | C. | 8+n-2m | D. | 2m-n-8 |
2.下列反应的离子方程式正确的是( )
| A. | Cu与FeCl3溶液反应:3Cu+2Fe3+═2Fe+3Cu2+ | |
| B. | 铁与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | Na与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 向AlCl3溶液中滴入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ |
 .
.