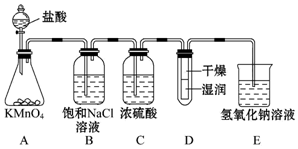
题目内容
8.某溶液中含有Ba2+、Ag+、Cu2+三种离子,现用①NaOH溶液;②K2SO4溶液;③HCl将这三种离子逐一沉淀并加以分离,则加入试剂顺序正确的是( )| A. | ①②③ | B. | ③②① | C. | ②③① | D. | ①③② |
分析 溶液含有Ba2+、Ag+、Cu2+,应先加入HCl,生成AgCl沉淀,过滤后在加入K2SO4,可得到BaSO4沉淀,最后加入NaOH,可得到Cu(OH)2沉淀,以此解答该题.
解答 解:Ag+、Cu2+均与NaOH反应生成沉淀,Ba2+、Ag+均与K2SO4溶液反应生成沉淀,则这三种离子逐一沉淀并加以分离,应先加入HCl,生成AgCl沉淀,过滤后在加入K2SO4,可得到BaSO4沉淀,最后加入NaOH,可得到Cu(OH)2沉淀,即顺序为③②①,
故选B.
点评 本题考查常见离子的检验及分离,为高频考点,把握离子之间反应为解答的关键,侧重分析与应用能力的考查,注意逐一沉淀的条件限制,题目难度不大.

练习册系列答案
相关题目
9.下列实验过程中产生的现象与右边座标图形相符合的是( )


| A. | 稀盐酸中加一定量CaCO3(横坐标是碳酸钙的质量,纵坐标为气体体积) | |
| B. | Ca(OH)2溶液中滴入溶液(横坐标是Na2CO3溶液的体积,纵坐标为沉淀质量) | |
| C. | 稀盐酸滴加到AgNO3溶液中(横坐标是稀盐酸的体积,纵坐标为溶液的导电能力) | |
| D. | 稀硫酸滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力) |
3.在150℃时,(NH4)2CO3分解的方程式为:(NH4)2CO3 $\frac{\underline{\;\;△\;\;}}{\;}$ 2NH3↑+H2O↑+CO2↑若完全分解,产生的气态混合物的密度是相同条件下氢气密度的( )
| A. | 12倍 | B. | 24倍 | C. | 48倍 | D. | 96倍 |
13.为了使Na2CO3溶液中$\frac{C(N{a}^{+})}{C{{O}_{3}}^{2-}}$的比值变小,可加入的物质是( )
| A. | 适量盐酸 | B. | 适量NaOH | C. | 适量NaHCO3 | D. | 适量KOH |
17.下列叙述正确的是( )
| A. | 氢氧化钠的摩尔质量是40 g | |
| B. | 1 mol NaOH的质量是40 g/mol | |
| C. | 1gH2和lgN2含分子数相等 | |
| D. | 等质量的N2、CH4、CO、H2O中,CH4含分子数最多 |