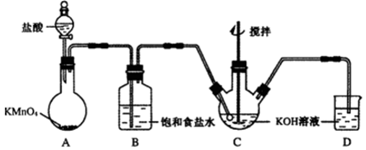
题目内容
13.为了使Na2CO3溶液中$\frac{C(N{a}^{+})}{C{{O}_{3}}^{2-}}$的比值变小,可加入的物质是( )| A. | 适量盐酸 | B. | 适量NaOH | C. | 适量NaHCO3 | D. | 适量KOH |
分析 Na2CO3溶液中,由于CO32-的水解,使得c(CO32-减小,如果要Na2CO3溶液中$\frac{c(N{a}^{+})}{c(C{{O}_{3}}^{2-})}$的比值变小,则需要抑制碳酸根离子水解,根据水解平衡的移动影响因素来回答
解答 解:A、加入盐酸,盐酸与CO32-反应,会使得碳酸根离子浓度减小,溶液中$\frac{c(N{a}^{+})}{c(C{{O}_{3}}^{2-})}$的比值变大,故A错误;
B、加NaOH溶液,溶液中c(Na+)增大,C(CO32-)减小,溶液中$\frac{c(N{a}^{+})}{c(C{{O}_{3}}^{2-})}$的比值变大,故B错误;
C、加NaOH 固体,溶液中c(Na+)增大,溶液中$\frac{c(N{a}^{+})}{c(C{{O}_{3}}^{2-})}$的比值变大,故C错误;
D、加入氢氧化钾固体,会抑制碳酸根水解,加入水稀释会导致溶液中离子浓度减小,溶液中$\frac{c(N{a}^{+})}{c(C{{O}_{3}}^{2-})}$的比值变小,故D正确;
故选D.
点评 本题考查学生盐的水解平衡的影响因素知识,注意知识的梳理和归纳是解题的关键,题目难度不大.

练习册系列答案
相关题目
8.某溶液中含有Ba2+、Ag+、Cu2+三种离子,现用①NaOH溶液;②K2SO4溶液;③HCl将这三种离子逐一沉淀并加以分离,则加入试剂顺序正确的是( )
| A. | ①②③ | B. | ③②① | C. | ②③① | D. | ①③② |
18.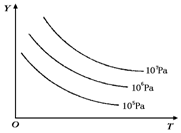 有下列可逆反应:L(s)+G(g)?2R(g)(正反应吸热),外界温度、压强的变化对该反应的影响如图所示:则下列对图中纵坐标Y的含义的有关叙述中正确的是( )
有下列可逆反应:L(s)+G(g)?2R(g)(正反应吸热),外界温度、压强的变化对该反应的影响如图所示:则下列对图中纵坐标Y的含义的有关叙述中正确的是( )
 有下列可逆反应:L(s)+G(g)?2R(g)(正反应吸热),外界温度、压强的变化对该反应的影响如图所示:则下列对图中纵坐标Y的含义的有关叙述中正确的是( )
有下列可逆反应:L(s)+G(g)?2R(g)(正反应吸热),外界温度、压强的变化对该反应的影响如图所示:则下列对图中纵坐标Y的含义的有关叙述中正确的是( )| A. | G的转化率 | B. | 平衡混合气中R的体积分数 | ||
| C. | 平衡混合气中G的体积分数 | D. | 平衡混合气中L的体积分数 |
5.下列装置或操作能达到试验目的是( )
| A. |  实验室制取并收集NH3 | B. |  石油的蒸馏 | ||
| C. |  检查装置气密性 | D. |  利用排空气发收集CO2 |
2.FeCl3溶液是实验室中使用比较广泛的一种试剂,下列有关离子方程式正确的是( )
| A. | FeCl3溶液使蓝色石蕊试纸变红:Fe3++3H2O═3H++Fe(OH)3 | |
| B. | FeCl3溶液中滴加氨水出现红褐色沉淀:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Cu2++Fe2+ | |
| D. | 检验溶液中的Fe3+用KSCN溶液:Fe3++3SCN-?Fe(SCN)3 |