题目内容
12.已知元素镓和砷的单质及其化合物在工业生产上有重要的用途.回答下列问题:(1)砷元素基态原子的电子排布式为[Ar]3d104s24p3.
(2)砷与氢元素可形成化合物砷化氢,该化合物的空间构型为三角锥,其中砷原子的杂化方式为sp3.
(3)根据等电子原理,写出由短周期元素组成且与砷化氢互为等电子体的一种离子的化学式H3O+.
(4)已知由元素砷与镓元素组成的化合物A为第三代半导体.已知化合物A的晶胞结构与金刚石相似,其中砷原子位于立方体内,镓原子位于立方体顶点和面心,请写出化合物A的化学式GaAs;
(5)已知铝与镓元素位于同一主族,金属铝属立方晶系,其晶胞边长为405pm,密度是2.70g•cm-3,通过计算确定铝原子在三维空间中堆积方式面心立方(已知NA=6.02×1023,1pm=10-10cm,4053=6.64×107); 晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)=143pm.
分析 (1)As所含质子数为33,原子核外电子数为33;
(2)根据价层电子对互斥理论确定AsH3的分子空间构型;
(3)根据等电子体是指具有相同价电子总数和原子总数的分子或离子来回答;
(4)由晶胞结构可知,晶胞中Ga原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、As原子数目=4,以此确定化学式;
(5)根据其密度、晶胞边长计算每个晶胞中含有的铝原子个数,根据铝原子个数判断晶体类型.
解答 解:(1)As所含质子数为33,原子核外电子数为33,根据能量最低原则、泡利不相容原理和洪特规则写出为[Ar]3d104s24p3,
故答案为:[Ar]3d104s24p3;
(2)AsH3中As原子含有3个σ键和1个孤电子对,所以AsH3为三角锥型,中心原子周围三个σ键和一对孤对电子对,所以是sp3杂化,
故答案为:三角锥;sp3;
(3)砷化氢含有4个原子,且价层电子数为11,则与H3O+互为等电子体,故答案为:H3O+;
(4)由晶胞结构可知,晶胞中Ga原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、As原子数目=4,故该化合物化学式为GaAs,故答案为:GaAs;
(5)根据密度公式可得N(Al)×$\frac{27}{40{5}^{3}}$×10-30×6.02×1023=2.70,由此解得每个晶胞中含有的原子数N(Al)=4.00,∴其晶胞的类型面心立方晶胞;
在面心立方晶胞中,每个面的对角线上三个原子紧挨着,所以对角线长度=$\sqrt{2}$×405pm,对角线为四个Al原子半径之和,所以每个铝原子半径=$\frac{\sqrt{2}×405pm}{4}$=143pm,故答案为:面心立方;143.
点评 本题考查了晶胞的计算、原子核外电子排布式的书写、晶体类型的判断等知识点,为高考常见题型,侧重考查学生的分析能力和计算能力,根据构造原理、密度公式、晶体类型与熔沸点的关系来分析解答,难点的晶胞的计算,注意:面心离子分别中,每个面对角线上三个原子紧挨着,而不是每个棱上两个原子紧挨着,为易错点.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案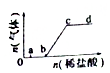 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )| A. | a点对应的溶液中:Na+、OH-、SO42-、NO3- | |
| B. | b点对应的溶液中:Al3+、Fe3+、NO3-、Cl- | |
| C. | c点对应的溶被中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:Fe2+、Na+、Cl-、NO3- |
| A. | HCl、H2SO4、S | B. | 金刚石、Na3PO4、Mg | ||
| C. | HF、SiC、Ar | D. | H2O、SiO2、K2CO3 |
几种有机物性质如表:
| 名称 | 性状 | 相对分 子质量 | 溶解度 | |||
| 冷水 | 热水 | 乙醇 | 乙醚 | |||
| 呋喃甲醛 | 无色液体 | 96 | 微溶 | 易溶 | 易溶 | 互溶 |
| 呋喃甲醇 | 无色液体 | 98 | 互溶 | 互溶 | 易溶 | 易溶 |
| 呋喃甲酸 | 无色晶体 | 112 | 微溶 | 易溶 | 可溶 | 易溶 |
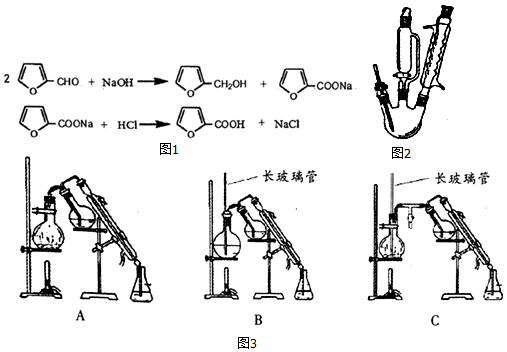
呋喃甲酸的实验室制备方法如图2:
三颈瓶中放人3.28mL(0.04mol)新蒸呋喃甲醛,控温8~12℃下滴加4mL40%NaOH溶液,并
磁力搅拌回流30分钟.向反应混合物滴加蒸馏水(约15mL)使其恰好澄清,用50mL乙醚萃取分液,其水溶液用水蒸气蒸馏,弃去镏出物,慢慢滴加2:1盐酸到pH=3,搅拌,析出结晶,抽滤并用少量水洗涤抽干,得精产品1.5g.
回答以下问题:
(1)三颈瓶中反应需要搅拌回流30分钟的原因是呋喃甲醛微溶于水,搅拌充分混合加快反应速率.
(2)呋喃甲醛在碱中反应大量放热,实验中需要控温8-12℃,其操作方法冷水浴.
(3)50mL乙醚萃取分液,除去呋喃甲醇的操作方法是C.
A、直接用50mL乙醚萃取分液
B、将溶液分两份,乙醚也分两份,分别萃取,萃取液合并
C、先用30mL乙醚萃取分液,再分别州l0mL乙醚萃取两次,并将三次萃取液合并
(4)乙醚提取后的水溶液要用盐酸酸化.配制100mL 2:1稀盐酸(水与盐酸体积比)的方法是用量筒分别量取66ml水、34ml浓盐酸,于烧杯中混合,用玻璃棒搅拌均匀;判断盐酸加入足量的方法是使用刚果红试纸测定溶液pH,当试纸变蓝紫色时,说明加入盐酸足量 (上层清液中继续滴加盐酸,不产生浑浊,说明盐酸加入足量).
(5)乙醚易挥发、易燃,蒸气可使人失去知觉,在蒸馏回收乙醚时注意:在水浴上进行蒸馏,切忌直接明火加热;水蒸气蒸馏的方法应选择(图3)C(填字母序号);
(6)计算呋喃甲酸的产率67%.
| 短周期元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的热稳定性:H2T<H2R | |
| B. | 单质与稀盐酸反应的速率:L<Q | |
| C. | 离子半径:R2-<L2+ | |
| D. | M与T形成的化合物既能与强酸反应,又能与强碱反应 |
 如图表示一个电解池,如果用电解方法精炼粗铜,电解液a选用硫酸铜溶液,则X电极是纯铜,Y的电极反应式是:Cu-2e-=Cu2+..
如图表示一个电解池,如果用电解方法精炼粗铜,电解液a选用硫酸铜溶液,则X电极是纯铜,Y的电极反应式是:Cu-2e-=Cu2+..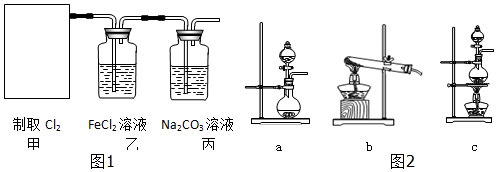
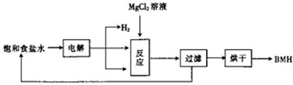 BMH{碱式次氯酸镁}[Mg2ClO(OH)n•H2O]}是一种白色粉末.难溶于水,是常用的无机抗菌剂,其一种生产工艺如图所示.
BMH{碱式次氯酸镁}[Mg2ClO(OH)n•H2O]}是一种白色粉末.难溶于水,是常用的无机抗菌剂,其一种生产工艺如图所示.