题目内容
17.下列各组中,含有离子晶体、分子晶体、原子晶体各一种的是( )| A. | HCl、H2SO4、S | B. | 金刚石、Na3PO4、Mg | ||
| C. | HF、SiC、Ar | D. | H2O、SiO2、K2CO3 |
分析 由离子键结合的物质为离子晶体,由分子构成的物质为分子晶体,由原子构成的物质且以共价键形成空间网状结构的物质为原子晶体,以此来解答.
解答 解:A、HCl、H2SO4、S均为分子晶体,故A不选;
B、金刚石为原子晶体,Na3PO4为离子晶体,Mg为金属晶体,故B不选;
C、HF、Ar为分子晶体,SiC为原子晶体,故C不选;
D、H2O为分子晶体,SiO2为原子晶体,K2CO3为离子晶体,故D选;
故选D.
点评 本题考查晶体的判断,明确不同类型晶体的构成微粒及作用力即可解答,难度不大.

练习册系列答案
相关题目
7.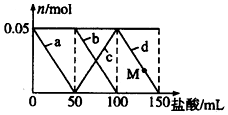 向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
 向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )| A. | a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3 | |
| B. | b和c曲线表示的离子反应是相同的 | |
| C. | M点时Al(OH)3的质量小于3.9g | |
| D. | 原混合溶液中的CO32-与AlO2-的物质的量之比为2:1 |
2.锂离子电池的应用很广,一种利用钛铁矿[主要成分为偏钛酸亚铁(FeTiO3),含有少量Fe2O3]制取钛白粉(TiO2)和利用其副产物制取锂离子电池的正极材料(LiFePO4)的工艺流程如图(部分条件未给出).
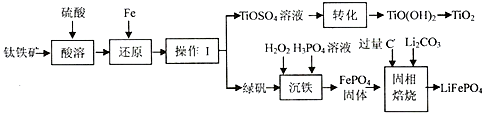
(1)FeTiO3中Ti的化合价为+4;在“还原”步骤中,还原“Fe3+”的反应中氧化剂和还原剂之比为2:1.
(2)FeSO4溶解度与温度关系如表,
则操作I 的名称为蒸发浓缩、冷却结晶、过滤.
(3)“转化”步骤中对溶液进行加热的主要目的是加快和促进水解.
(4)写出“沉铁”的离子反应方程式2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+,为使Fe3+完全沉降,则PO43-的浓度至少应为9.91×10-11mol/L(己知:ksp (FePO4•2H2O)=9.91×10-16).
(5)流程中可循环利用的物质是(H2O除外)H2SO4,写出固相焙烧的反应方程式2FePO4+Li2CO3+2C$\frac{\underline{\;焙烧\;}}{\;}$2LiFePO4+3CO↑.
(6)某锂离子充放电时,正极发生LiFePO4与FePO4的转化,当充电时,电池负极发生的反应为6C+xLi++xe-=LixC6,写出放电时电池反应方程式xFePO4+LixC6=6C+xLiFePO4.

(1)FeTiO3中Ti的化合价为+4;在“还原”步骤中,还原“Fe3+”的反应中氧化剂和还原剂之比为2:1.
(2)FeSO4溶解度与温度关系如表,
| 温度(℃) | 30 | 20 | l5 | l0 | 5 | 0 | -2 | -6 |
| FeSO4(g/L) | 240 | 190 | 130 | 117 | 95 | 79 | 59 | 38 |
(3)“转化”步骤中对溶液进行加热的主要目的是加快和促进水解.
(4)写出“沉铁”的离子反应方程式2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+,为使Fe3+完全沉降,则PO43-的浓度至少应为9.91×10-11mol/L(己知:ksp (FePO4•2H2O)=9.91×10-16).
(5)流程中可循环利用的物质是(H2O除外)H2SO4,写出固相焙烧的反应方程式2FePO4+Li2CO3+2C$\frac{\underline{\;焙烧\;}}{\;}$2LiFePO4+3CO↑.
(6)某锂离子充放电时,正极发生LiFePO4与FePO4的转化,当充电时,电池负极发生的反应为6C+xLi++xe-=LixC6,写出放电时电池反应方程式xFePO4+LixC6=6C+xLiFePO4.
9.分子式为 C7H16的烷烃中,含有三个甲基的同分异构体共几种( )
| A. | 1 种 | B. | 2 种 | C. | 3 种 | D. | 4 种 |
6.下列有机实验操作或叙述正确的是( )
| A. | 将乙烯和乙炔气体分别通入溴的四氯化碳溶液中,两者都褪色 | |
| B. | 甲烷和氯气在室温下的光照环境中可以稳定存在 | |
| C. | 苯能使溴水褪色是因为二者反应生成了溴苯 | |
| D. | 要除去乙烷中的乙烯制得纯净的乙烷,将混合气体通入酸性高锰酸钾溶液中 |
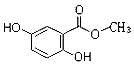
 .
.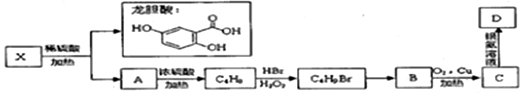
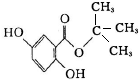 ,C4H9Br→B的化学反应是取代反应.
,C4H9Br→B的化学反应是取代反应. .
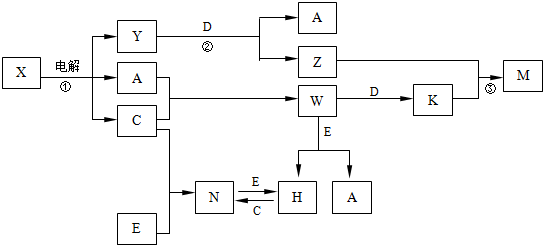
.
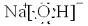 ,构成C单质的元素在周期表中位于第三周期第VIIA族
,构成C单质的元素在周期表中位于第三周期第VIIA族