题目内容
2.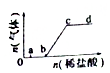 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )| A. | a点对应的溶液中:Na+、OH-、SO42-、NO3- | |
| B. | b点对应的溶液中:Al3+、Fe3+、NO3-、Cl- | |
| C. | c点对应的溶被中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:Fe2+、Na+、Cl-、NO3- |
分析 由图可知,a点对应的溶液含Na2CO3、NaHCO3,b点溶液含NaHCO3,c点溶质为NaCl,显中性,而d点溶液显酸性,含HCl,结合离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应、水解反应等,则离子大量共存,以此来解答.
解答 解:A.a点对应的溶液含NaHCO3,不能大量存在OH-,故A不选;
B.b点溶液含NaHCO3,分别与Al3+、Fe3+发生相互促进水解反应,不能共存,故B不选;
C.c点为中性,该组离子之间不反应,可大量共存,故C选;
D.d点显酸性,Fe2+、H+、NO3-发生氧化还原反应,不能共存,故D不选;
故选C.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
12.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒 | |
| B. | 25℃、1.01×105 Pa下,44g CO2中含有的原子数为3NA | |
| C. | 1 L 0.5mol/L Na2CO3 溶液中含有的CO32-数目为0.5NA | |
| D. | 1 mol Cl2与足量Fe反应,转移的电子数为3NA |
13.下列关于仪器使用和操作说法不正确的是( )
| A. | 蒸发时,给蒸发皿内液体加热时,液体不超过容器的$\frac{2}{3}$ | |
| B. | 蒸馏操作时,冷凝管中进冷凝水应是“下进上出” | |
| C. | 盛放NaOH溶液时,使用带橡胶塞的磨口瓶 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度比水大 |
10.向混合溶液甲中缓慢滴加溶液乙,反应生成沉淀的质量如图所示,其中可能符合图象的一组是( )
| 甲 | 乙 | 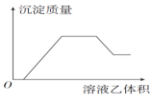 | |
| A | NH4NO3、Al(NO3)3、HCl、Fe(NO3)3 | NaOH | |
| B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 | |
| C | AlCl3、Mg(NO3)2、HNO3 | NaOH | |
| D | NaAlO2、NH3•H2O、NaOH | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
17.在一定温度时,将1mol A和2mol B放入容积为5L的某密闭容器中发生如下反应:A(s)+2B(g)?C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol/L.下列叙述不正确的是( )
| A. | 在5min内该反应用C的浓度变化表示的反应速率为0.2mol/(L•min) | |
| B. | 5min时,容器内D的浓度为0.2mol/L | |
| C. | 当容器内压强保持恒定时,该可逆反应达到平衡状态 | |
| D. | 5min时容器内气体总的物质的量为3mol |
7.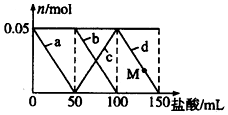 向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
 向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )| A. | a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3 | |
| B. | b和c曲线表示的离子反应是相同的 | |
| C. | M点时Al(OH)3的质量小于3.9g | |
| D. | 原混合溶液中的CO32-与AlO2-的物质的量之比为2:1 |
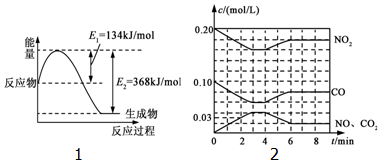 随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.