题目内容
20.氯气是一种重要的工业原料.(1)写出实验室制取氯气反应的化学方程式4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O.
(2)资料显示:Ca(ClO)2+CaCl2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+2Cl2↑+2H2O.某学习小组利用此原理设计如图1所示装置制取氯气并探究其性质.
①在该实验中,甲部分的装置是c(填字母).
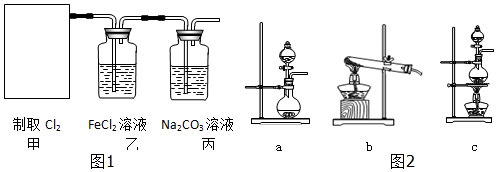
②乙装置中FeCl2溶液与Cl2反应的离子方程式是Cl2+2Fe2+=2Cl-+2Fe3+.
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质,这种物质是NaClO(化学式).
④有人认为该实验存在明显的缺陷,请你将认为缺少的部分在图2中的相应位置画出,并在添加的装置中标明需要放入的最合适的化学试剂.
请你写出Cl2和“④”中“最合适的化学试剂”反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
分析 (1)二氧化锰和浓盐酸在加热的条件下反应生成氯化锰、氯气和水;
(2)①依据反应物的状态和反应的条件选择发生装置;
②氯气具有强的氧化性,能够氧化二价铁离子;
③氯气和水反应生成盐酸和次氯酸,盐酸和足量碳酸钠反应生成氯化钠和碳酸氢钠,次氯酸和碳酸钠反应生成次氯酸钠和碳酸氢钠;
④氯气有毒不能直接排放到空气中.
解答 解:(1)二氧化锰和浓盐酸在加热的条件下反应生成氯化锰、氯气和水,方程式为:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O;
故答案为:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O;
(2)①氯化钙和次氯酸钙为固体,硫酸为液体,反应条件需要加热,所以应选择c装置;
故答案为:c;
②氯气具有强的氧化性,能够氧化二价铁离子,则氯气与氯化亚铁反应的离子方程式:Cl2+2Fe2+=2Cl-+2Fe3+;故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;
③氯气与碳酸钠溶液反应生成氯化钠次氯酸钠和碳酸氢钠,反应的化学方程式为:Cl2+H2O+2Na2CO3=NaCl+NaClO+2NaHCO3 ;则制得的生活中常用的漂白、消毒的物质为NaClO;故答案为:NaClO;
④氯气有毒不能直接排放到空气中,应进行尾气处理,实验室常用氢氧化钠溶液吸收过量的氯气,装置图为 ;反应的离子方程式为;Cl2+2OH-=Cl-+ClO-+H2O;
;反应的离子方程式为;Cl2+2OH-=Cl-+ClO-+H2O;
故答案为: ;Cl2+2OH-=Cl-+ClO-+H2O.
;Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查了氯气的性质,为高频考点,侧重于学生的分析、实验能力的考查,难度不大,注意把握实验的方法和操作注意事项,结合物质的性质解答该题.

| 甲 | 乙 |  | |
| A | NH4NO3、Al(NO3)3、HCl、Fe(NO3)3 | NaOH | |
| B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 | |
| C | AlCl3、Mg(NO3)2、HNO3 | NaOH | |
| D | NaAlO2、NH3•H2O、NaOH | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 物质的量浓度为0.5 mol/L的MgCl 2溶液中,共含有Cl - 个数为 N A | |
| B. | 1mol任何气体的体积都为 22.4L | |
| C. | 7.8gNa 2O 2中所含阴离子的数目是0.1N A | |
| D. | 标准状况下,2.24L水中含有的分子数为0.1N A |
| A. | 1 种 | B. | 2 种 | C. | 3 种 | D. | 4 种 |
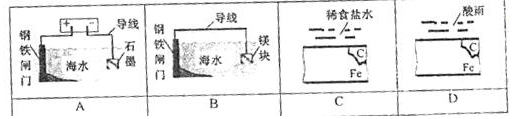
| A. | A | B. | B | C. | C | D. | D |
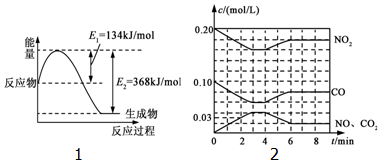 随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
 .
.
 ,C4H9Br→B的化学反应是取代反应.
,C4H9Br→B的化学反应是取代反应. .
.