题目内容
1.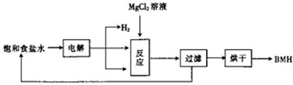 BMH{碱式次氯酸镁}[Mg2ClO(OH)n•H2O]}是一种白色粉末.难溶于水,是常用的无机抗菌剂,其一种生产工艺如图所示.
BMH{碱式次氯酸镁}[Mg2ClO(OH)n•H2O]}是一种白色粉末.难溶于水,是常用的无机抗菌剂,其一种生产工艺如图所示.(1)BMH的化学式中n=3(填数字).
(2)电解饱和食盐水时发生反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-.
(3)流程图中“反应”步骤生成BMH的化学方程式为2MgCl2+Cl2+5NaOH=Mg2ClO(OH)3•H2O↓+5NaCl.
(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:毎克含氯消毒剂的氧化能力相当于多少克CL2的氧化能力.BMH中的有效氯含量为0.421(计算结果保留两位小数).
分析 Mg2ClO(OH)n•H2O中,由化合价代数和为0可知n=3,氯化镁溶液与次氯酸钠溶液混合后,加入氢氧化钠溶液调节溶液pH,发生反应:2MgCl2+Cl2+5NaOH=Mg2ClO(OH)3•H2O↓+5NaCl,然后通过滤、洗涤、干燥获得碱式次氯酸镁,
(1)根据化合价代数和为0判断n值;
(2)电解饱和食盐水生成氯气、氢气和氢氧化钠;
(3)反应物为氯气、氢氧化钠和氯化镁,生成}[Mg2ClO(OH)3•H2O;
(4)1gMg2ClO(OH)3•H2O的物质的量为$\frac{1}{168.5}$mol,依据电子转移数目相等,Mg2ClO(OH)3•H2O~Cl-~2e-,Cl2~2Cl-~2e-,可知氯气的物质的量,可计算氯气的质量.
解答 解:(1)Mg2ClO(OH)n•H2O中,由化合价代数和为0可知n=3,故答案为:3;
(2)电解饱和食盐水生成氯气、氢气和氢氧化钠,方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-;
(3)反应物为氯气、氢氧化钠和氯化镁,生成Mg2ClO(OH)3•H2O,则反应的化学方程式为2MgCl2+Cl2+5NaOH=Mg2ClO(OH)3•H2O↓+5NaCl,
故答案为:2MgCl2+Cl2+5NaOH=Mg2ClO(OH)3•H2O↓+5NaCl;
(4)1gMg2ClO(OH)3•H2O的物质的量为$\frac{1}{168.5}$mol,依据电子转移数目相等,Mg2ClO(OH)3•H2O~Cl-~2e-,Cl2~2Cl-~2e-,可知氯气的物质的量为$\frac{1}{168.5}$mol,质量为$\frac{1}{168.5}$mol×71g/mol=1.57g,
故答案为:0.421.
点评 本题考查了制备方案的设计方法,为高频考点,侧重考查学生的分析能力、实验能力和计算能力的考查,题目难度中等,涉及化学实验基本操作方法及仪器的使用、离子方程式、化学方程式等知识,明确制备原理为解答关键,试题培养了学生的分析能力及化学实验能力.

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案| A. | 称取碳酸钠晶体(Na2CO3•10H2O)100g来配制0.5mol/L的Na2CO3溶液1000mL | |
| B. | 配制NH3NO3溶液,在烧杯中溶解后立即注入容量瓶,并立即进行下面的各项操作 | |
| C. | 定容后,将容量瓶振荡均匀,静置时发现液面低于刻度线,于是又加入少量水至刻度线 | |
| D. | 容量瓶用蒸馏水洗净后未经干燥马上用来配制溶液 |
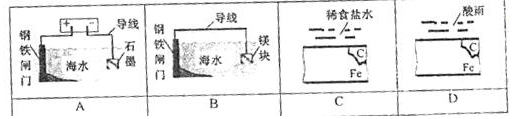
| A. | A | B. | B | C. | C | D. | D |
| A. | 乙烷和乙烯均可使酸性KMnO4溶液褪色 | |
| B. | 甲烷燃烧会生成CO2,因此不属于清洁能源 | |
| C. | 向甲苯中滴入少量浓溴水,振荡,静置,溶液分层,上层呈橙红色,下层几乎无色,可知甲苯和溴水发生取代反应,使溴水褪色 | |
| D. | 水煤气、裂解气、焦炉气、天然气都是混合物 |
| A. | 在0.1mol•L-1 Na2SO3溶液溶液中:c(Na+)═2c(SO32-)+c(HSO3-)+c(H2SO3) | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)-c(H+)═c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CaCl2混合溶液中:c(Na+)+c(Ca2+)═c(CH3COOH)+c(CH3COO-)+2 c(Cl-) |
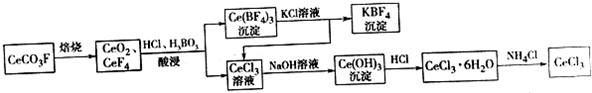
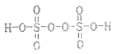 ,其中S元素的化合价为:+6.过硫酸铵(NH4)2Fe(SO4)2溶液将Ce3+氧化Ce4+为的离子方程式为:S2O42-+2Ce3+=2Ce4++2SO42-
,其中S元素的化合价为:+6.过硫酸铵(NH4)2Fe(SO4)2溶液将Ce3+氧化Ce4+为的离子方程式为:S2O42-+2Ce3+=2Ce4++2SO42-
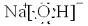 ,构成C单质的元素在周期表中位于第三周期第VIIA族
,构成C单质的元素在周期表中位于第三周期第VIIA族