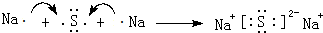题目内容
15.下列有关阿伏伽德罗常数说法正确的是( )| A. | 标准状况下,1.12L CCl4含有Cl原子数目为0.4 NA | |
| B. | 17g OH-所含电子数为9NA | |
| C. | 39g Na2O2与足量H2O反应,转移电子数为NA | |
| D. | 常温常压下,CO2与N2O的混合气体共44 g,其中含有的原子总数为3NA |
分析 A.标况下四氯化碳为液体;
B.1个氢氧根离子含有10个电子;
C.过氧化钠与水反应为歧化反应,过氧化钠既是氧化剂又是还原剂;
D.质量转化为物质的量,结合CO2与N2O都是三原子分子解答;
解答 解;A.标况下四氯化碳为液体,不能使用气体摩尔体积,故A错误;
B.17g OH-物质的量为$\frac{17g}{17g/mol}$=1mol,含有电子数为10NA,故B错误;
C.过氧化钠与水反应为歧化反应,过氧化钠既是氧化剂又是还原剂,反应1mol过氧化钠转移1mol电子,39g Na2O2物质的量为0.5mol,与足量H2O反应,转移电子数为0.5NA,故C错误;
D.CO2与N2O相对分子质量都是44,所以CO2与N2O的混合气体共44 g物质的量为1mol,含有原子个数3mol,原子总数为3NA,故D正确;
故选:D.
点评 本题考查阿伏伽德罗常数的有关计算和判断,掌握公式的使用和物质的结构是关键,注意气体摩尔体积使用条件和对象,注意过氧化钠与水反应中元素化合价变化,题目难度中等.

练习册系列答案
相关题目
3.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | pH=2 的H2C2O4 溶液与pH=12 的NaOH 溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| B. | 0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | pH相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]<c(NH4Cl) |
10.将8g NaOH溶解在10mL水中,再稀释成1L溶液,从中取出10mL,这10mL溶液的物质的量浓度为( )
| A. | 2 mol•L-1 | B. | 0.2 mol•L-1 | C. | 0.02mol•L-1 | D. | 20 mol•L-1 |
20.物质之间发生化学反应时,一定发生变化的是( )
| A. | 原子核 | B. | 化学键 | C. | 物质的存在状态 | D. | 物质的颜色 |
7.在1L的密闭容器中通入2molNH3,在一定温度下发生下列反应:2NH3?N2+3H2,达到平衡时,容器内N2的体积百分含量为a%.若维持容器的体积和温度都不变,分别通入下列初始物质,达到平衡时,容器内N2的体积百分含量也为a%的是( )
| A. | 3molH2+2molN2 | B. | 4molNH3 | ||
| C. | 2molN2+6molH2 | D. | 1molNH3+0.5molN2+1.5molH2 |
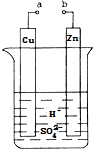 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
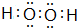 ,所含的化学键类型为共价键.
,所含的化学键类型为共价键.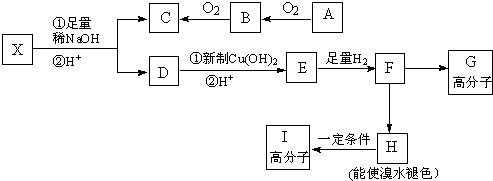
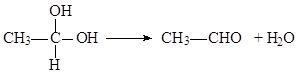
 .
.