题目内容
4.现有分子式为C10H10O2Br2的芳香族化合物X,其苯环上的一溴代物只有一种,其分子中有四种不同环境的氢,且个数比为1:2:6:1,在一定条件下可发生下述一系列反应,其中C能发生银镜反应,E遇FeCl3溶液显色且能与浓溴水反应.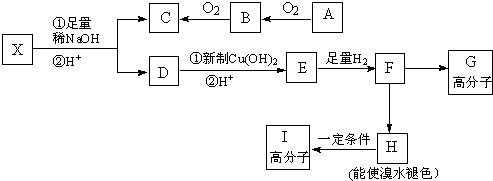
已知:①在稀碱溶液中,溴苯难发生水解
②
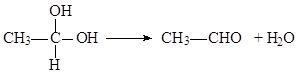
请回答下列问题:
(1)D 中含有官能团的名称是醛基、羟基;A→B化学方程式2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O.
(2)写出高分子I的结构简式:
 .
.(3)1molX最多能与4molNaOH反应
(4)①F→H反应条件为浓硫酸、加热;
②如何鉴别B和C物质分别取样于试管中,加少量锌粒,有气泡产生的是C.
分析 A能连续被氧化,则A是醇,B是醛,C是羧酸,C能发生银镜反应,则C是甲酸或二甲酸,X水解生成C和D,且X中只含2个氧原子,所以C是HCOOH,B是HCHO,A是CH3OH.
D能与新制氢氧化铜反应生成E,说明D中含有醛基,说明D中含有酚羟基,由于在稀碱溶液中,连在苯环上的溴原子不易发生水解,说明X中酯基为甲酸与酚形成的,即存在HCOO-,两个羟基同时连在同一碳原子上的结构是不稳定,会发生脱水反应,说明存在-CHBr2,芳香族化合物X苯环上的一卤代物只有一种,说明X中苯环上只有一类氢原子,其核磁共振氢谱图中有四个吸收峰,说明含有4种氢原子,吸收峰的面积比为1:2:6:1,且X含有2个甲基,结合E遇FeCl3溶液显色且能与浓溴水反应,故HCOO-基团的邻、对位位置有H原子,综上分析可推知X的结构简式为: ,X水解然后酸化得D,D的结构简式为:
,X水解然后酸化得D,D的结构简式为: ,D被氧化生成E,E的结构简式为:
,D被氧化生成E,E的结构简式为: ,E和氢气发生加成反应生成F,F的结构简式为:
,E和氢气发生加成反应生成F,F的结构简式为: ,F发生缩聚反应生成G,G的结构简式为:
,F发生缩聚反应生成G,G的结构简式为: ,F反应生成H,H能和溴水发生加成反应,所以F发生消去反应生成H,则H的结构简式为:
,F反应生成H,H能和溴水发生加成反应,所以F发生消去反应生成H,则H的结构简式为: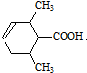 ,H能发生加聚反应生成I,I的结构简式为:
,H能发生加聚反应生成I,I的结构简式为: ,据此解答.
,据此解答.
解答 解:A能连续被氧化,则A是醇,B是醛,C是羧酸,C能发生银镜反应,则C是甲酸或二甲酸,X水解生成C和D,且X中只含2个氧原子,所以C是HCOOH,B是HCHO,A是CH3OH.
D能与新制氢氧化铜反应生成E,说明D中含有醛基,说明D中含有酚羟基,由于在稀碱溶液中,连在苯环上的溴原子不易发生水解,说明X中酯基为甲酸与酚形成的,即存在HCOO-,两个羟基同时连在同一碳原子上的结构是不稳定,会发生脱水反应,说明存在-CHBr2,芳香族化合物X苯环上的一卤代物只有一种,说明X中苯环上只有一类氢原子,其核磁共振氢谱图中有四个吸收峰,说明含有4种氢原子,吸收峰的面积比为1:2:6:1,且X含有2个甲基,结合E遇FeCl3溶液显色且能与浓溴水反应,故HCOO-基团的邻、对位位置有H原子,综上分析可推知X的结构简式为: ,X水解然后酸化得D,D的结构简式为:
,X水解然后酸化得D,D的结构简式为: ,D被氧化生成E,E的结构简式为:
,D被氧化生成E,E的结构简式为: ,E和氢气发生加成反应生成F,F的结构简式为:
,E和氢气发生加成反应生成F,F的结构简式为: ,F发生缩聚反应生成G,G的结构简式为:
,F发生缩聚反应生成G,G的结构简式为: ,F反应生成H,H能和溴水发生加成反应,所以F发生消去反应生成H,则H的结构简式为:
,F反应生成H,H能和溴水发生加成反应,所以F发生消去反应生成H,则H的结构简式为: ,H能发生加聚反应生成I,I的结构简式为:
,H能发生加聚反应生成I,I的结构简式为: .
.
(1)D 为 ,含有官能团是醛基、羟基,A→B化学方程式:2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O,
,含有官能团是醛基、羟基,A→B化学方程式:2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O,
故答案为:醛基、羟基;2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O;
(2)高分子I的结构简式: ,故答案为:
,故答案为: ;
;
(3)X为 ,溴原子能与氢氧化钠反应,酯基水解得到甲酸与酚羟基能与氢氧化钠反应,故1molX最多能与4molNaOH反应,故答案为:4;
,溴原子能与氢氧化钠反应,酯基水解得到甲酸与酚羟基能与氢氧化钠反应,故1molX最多能与4molNaOH反应,故答案为:4;
(4)①F→H发生醇的消去反应,反应条件为:浓硫酸、加热,故答案为:浓硫酸、加热;
②B是HCHO,C是HCOOH,均含有醛基,但C含有羧基,鉴别B和C物质的方法为:分别取样于试管中,加少量锌粒,有气泡产生的是C,
故答案为:分别取样于试管中,加少量锌粒,有气泡产生的是C.
点评 本题考查有机物的推断,对学生的逻辑推理有较高的要求,采取正、逆推法相结合确定X结构,注意X和氢氧化钠的水溶液发生水解时不仅酯基水解,溴原子还水解,含有溴原子的碳原子上有两个羟基时不稳定,易变成醛基,为易错点.

 阅读快车系列答案
阅读快车系列答案①锌粒与稀H2SO4反应制取H2
②氢气在氧气中燃烧
③碳酸钙高温分解成氧化钙和二氧化碳
④氢氧化钾和硫酸中和
⑤Ba(OH)2•8H2O与NH4Cl反应
⑥氢气还原氧化铜
⑦葡萄糖在人体内氧化分解
⑧钢铁制品生锈的反应.
| A. | ①②③④ | B. | ③⑤⑥ | C. | ③⑤⑥⑦ | D. | ①②④⑧ |
| A. | 标准状况下,1.12L CCl4含有Cl原子数目为0.4 NA | |
| B. | 17g OH-所含电子数为9NA | |
| C. | 39g Na2O2与足量H2O反应,转移电子数为NA | |
| D. | 常温常压下,CO2与N2O的混合气体共44 g,其中含有的原子总数为3NA |
| 选项 | 待提纯的物质 | 选用试剂 | 操作的方法 |
| A | FeCl2溶液(FeCl3溶液) | 铁粉 | 过滤 |
| B | Al2O3(Fe2O3) | NaOH溶液和CO2 | 溶解、过滤、过滤 |
| C | Cl2(HCl) | 饱和食盐水 | 洗气 |
| D | Fe(OH)3胶体(NaCl溶液) | 水 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
| A. | ⅠA族元素也称为碱金属元素 | |
| B. | 稀有气体元素原子的最外层电子数均为8 | |
| C. | 元素周期表中最右上角元素的非金属性最强 | |
| D. | 元素周期表有18个纵行,16个族 |
焙烧炉中:2ZnS(s)+3O2(g)→2ZnO(s)+2SO2(g) ①
鼓风炉中:2C(s)+O2(g)→2CO ②
鼓风炉中:ZnO(s)+CO(g)?Zn(g)+CO2(g) ③
(1)已知闪锌矿中含硫的质量分数为16.0%,而所含杂质不含硫,则闪锌矿中硫化锌的质量分数为48.5%.现代工业生产多采用联合生产,可将闪锌矿中的硫用于生产硫酸.现有
此闪锌矿100t,在理论上可生产出98.0%的硫酸50t.
(2)焙烧炉产生的炉气中SO2的体积分数不超过14.3%(保留小数点后一位小数,下同).
(3)鼓风炉容积固定,炉内部分气态物质其物质的量浓度(mol/L)变化如下:
| 时间/min | CO | Zn | CO2 |
| 0 | 0.11 | 0 | 0 |
| 2 | 0.10 | 0.01 | 0.01 |
| 3 | 0.01 | 0.10 | 0.10 |
| 4 | 0.01 | 0.10 | 0.10 |
(4)若ZnS全部转化为Zn,焙烧炉出来的N2、O2、SO2混合气体中N2占82.5%,鼓风炉中CO的转化率为62.5%,而O2无剩余,试列式计算每生产1mol Zn,应向焙烧炉和鼓风炉中鼓入新鲜空气共多少升(S.T.P)?
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解.
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如下(中间产物的固体部分已经略去):
 已知各种金属离子完全沉淀的pH如下表:
已知各种金属离子完全沉淀的pH如下表:| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+
此空删去,另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用.
| 序号 | ① | ② | ③ | ④ |
| 仪器装置 | 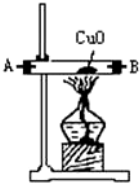 | 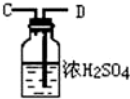 | 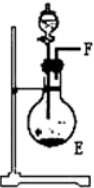 |  |
(1)这些装置按气流方向自左向右的连接顺序是(填A、B、C…)F→G→H→A→B→D→C(A、B顺序可颠倒).
(2)E中发生反应的化学方程式是CaO+NH3•H2O=Ca(OH)2+NH3↑.
(3)装置④中应当选用的干燥剂是(写名称)碱石灰.
(4)装置①中发生氧化还原反应的化学方程式是2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2↑3H2O+3Cu.其中氧化剂是CuO,氧化产物是N2(写化学式).
(5)装置②中浓硫酸的作用是除去水蒸气和氨气.