题目内容
20.物质之间发生化学反应时,一定发生变化的是( )| A. | 原子核 | B. | 化学键 | C. | 物质的存在状态 | D. | 物质的颜色 |
分析 化学反应的实质是旧键断裂,新键形成;在化学变化中,一定生成新物质,即化学变化中分子种类一定发生改变,化学键一定发生变化.
解答 解:A.化学反应的最小微粒是原子,故原子核不发生改变,故A错误;
B.化学变化中分子种类一定发生改变,化学键一定发生变化,故B正确;
C.在化学变化中,状态不一定发生改变,故C错误;
D.在化学变化中,颜色不一定发生改变,故D错误.
故选B.
点评 本题考查化学反应的实质,难度不大,注意化学反应的实质是旧键断裂,新键形成.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
10.已知元素A~E表示元素周期表中短周期的四种元素,请根据表中信息回答下列问题.
(1)A在元素周期表中的位置为第二周期第ⅣA族,元素A的一种同位素可测定文物年代,这种同位素的符号是146C.比较B、D、E的离子半径的大小S2->O2->Na+(用离子符号表示).
(2)用电子式表示元素B形成的10e-的氢化物分子的形成过程 .
.
(3)已知E在B的单质中燃烧生成淡黄色的固体,该固体化合物的电子式为 .
.
(4)C的氢化物和C的最高价氧化物的水化物反应生成甲,甲是离子化合物(填“共价化合物”或“离子化合物”),甲中的化学键类型为离子键、共价键.
(5)请写出 A的单质与D的最高价含氧酸反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(6)元素D的气态氢化物与过氧化氢溶液混合后有浅黄色固体生成,请写出发生的化学方程式H2O2+H2S=S↓+2H2O.
| 元素 | 性质或结构信息 |
| A | 组成有机物的必须元素 |
| B | 原子最外层电子数是电子层数的3倍. |
| C | 工业上通过分离液态空气获得其单质.原子的最外层电子数是内层电子总数的2.5倍. |
| D | 单质是黄色晶体,不溶于水,微溶于酒精,易溶于二硫化碳,游离态的D存在于火山喷口附近或地壳的岩层里. |
| E | 最高价氧化物的水化物能电离出与Ne电子数相等的阴阳离子. |
(2)用电子式表示元素B形成的10e-的氢化物分子的形成过程
 .
.(3)已知E在B的单质中燃烧生成淡黄色的固体,该固体化合物的电子式为
 .
.(4)C的氢化物和C的最高价氧化物的水化物反应生成甲,甲是离子化合物(填“共价化合物”或“离子化合物”),甲中的化学键类型为离子键、共价键.
(5)请写出 A的单质与D的最高价含氧酸反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(6)元素D的气态氢化物与过氧化氢溶液混合后有浅黄色固体生成,请写出发生的化学方程式H2O2+H2S=S↓+2H2O.
11.从化学的角度将下列物质进行分类,下列说法正确的是( )
| A. | 因为CO和CO2的组成元素完全相同,所以CO与CO2互为同素异形体 | |
| B. | 因为金刚石与石墨的化学式相同,所以金刚石与石墨互为同分异构体 | |
| C. | 互为同分异构体的物质具有相同的分子式 | |
| D. | 由4个氧原子构成的氧分子O4是一种新的氧化物 |
15.下列有关阿伏伽德罗常数说法正确的是( )
| A. | 标准状况下,1.12L CCl4含有Cl原子数目为0.4 NA | |
| B. | 17g OH-所含电子数为9NA | |
| C. | 39g Na2O2与足量H2O反应,转移电子数为NA | |
| D. | 常温常压下,CO2与N2O的混合气体共44 g,其中含有的原子总数为3NA |
5.为除去括号内杂质,下列有关试剂和操作方法不正确的是( )
| A. | 溴苯(苯):蒸馏 | B. | 苯(苯酚):加溴水振荡后,过滤 | ||
| C. | 乙烷(乙烯):溴水,洗气 | D. | 苯(溴):稀NaOH溶液,分液 |
12.除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法不正确的是( )
| 选项 | 待提纯的物质 | 选用试剂 | 操作的方法 |
| A | FeCl2溶液(FeCl3溶液) | 铁粉 | 过滤 |
| B | Al2O3(Fe2O3) | NaOH溶液和CO2 | 溶解、过滤、过滤 |
| C | Cl2(HCl) | 饱和食盐水 | 洗气 |
| D | Fe(OH)3胶体(NaCl溶液) | 水 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
9.现代炼锌的方法可分为火法和湿法两大类.火法炼锌是将闪锌矿(主要含ZnS)焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1100℃~1300℃,使锌蒸馏出来(设空气中N2、O2的体积分数分别为0.80、0.20),主要反应为:
焙烧炉中:2ZnS(s)+3O2(g)→2ZnO(s)+2SO2(g) ①
鼓风炉中:2C(s)+O2(g)→2CO ②
鼓风炉中:ZnO(s)+CO(g)?Zn(g)+CO2(g) ③
(1)已知闪锌矿中含硫的质量分数为16.0%,而所含杂质不含硫,则闪锌矿中硫化锌的质量分数为48.5%.现代工业生产多采用联合生产,可将闪锌矿中的硫用于生产硫酸.现有
此闪锌矿100t,在理论上可生产出98.0%的硫酸50t.
(2)焙烧炉产生的炉气中SO2的体积分数不超过14.3%(保留小数点后一位小数,下同).
(3)鼓风炉容积固定,炉内部分气态物质其物质的量浓度(mol/L)变化如下:
则鼓风炉中CO总的转化率为90.9%;若生产中CO总的利用率为95.0%,列式计算每生产1molZn,至少需要补充焦炭多少克?
(4)若ZnS全部转化为Zn,焙烧炉出来的N2、O2、SO2混合气体中N2占82.5%,鼓风炉中CO的转化率为62.5%,而O2无剩余,试列式计算每生产1mol Zn,应向焙烧炉和鼓风炉中鼓入新鲜空气共多少升(S.T.P)?
焙烧炉中:2ZnS(s)+3O2(g)→2ZnO(s)+2SO2(g) ①
鼓风炉中:2C(s)+O2(g)→2CO ②
鼓风炉中:ZnO(s)+CO(g)?Zn(g)+CO2(g) ③
(1)已知闪锌矿中含硫的质量分数为16.0%,而所含杂质不含硫,则闪锌矿中硫化锌的质量分数为48.5%.现代工业生产多采用联合生产,可将闪锌矿中的硫用于生产硫酸.现有
此闪锌矿100t,在理论上可生产出98.0%的硫酸50t.
(2)焙烧炉产生的炉气中SO2的体积分数不超过14.3%(保留小数点后一位小数,下同).
(3)鼓风炉容积固定,炉内部分气态物质其物质的量浓度(mol/L)变化如下:
| 时间/min | CO | Zn | CO2 |
| 0 | 0.11 | 0 | 0 |
| 2 | 0.10 | 0.01 | 0.01 |
| 3 | 0.01 | 0.10 | 0.10 |
| 4 | 0.01 | 0.10 | 0.10 |
(4)若ZnS全部转化为Zn,焙烧炉出来的N2、O2、SO2混合气体中N2占82.5%,鼓风炉中CO的转化率为62.5%,而O2无剩余,试列式计算每生产1mol Zn,应向焙烧炉和鼓风炉中鼓入新鲜空气共多少升(S.T.P)?
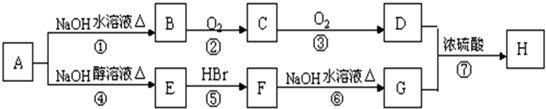
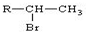 (R为烃基)
(R为烃基)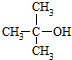 .
.