题目内容
5.A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,能生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和.(1)A为C,B为O,C为Na,D为S.(填元素符号)
(2)D的最高价氧化物的水化物的化学式是H2SO4,用电子式表示C与D形成的化合物的形成过程
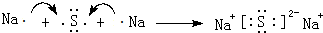
(3)写出由A、B组成的化合物与E反应的化学方程式:2Na2O2+CO2=2Na2CO3+O2.
分析 A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,固体E为Na2O2,B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,核外各层电子分别为2、8、6,则D为S元素,据此解答.
解答 解:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,固体E为Na2O2,B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,核外各层电子分别为2、8、6,则D为S元素.
(1)由上述分析可知,A为C元素、B为O元素、C为Na元素、D为S元素,故答案为:C;O;Na;S;
(2)D为S元素,最高价氧化物的水化物的化学式是H2SO4,C与D形成的化合物为Na2S,用电子式表示形成过程为: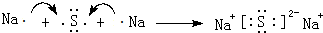 ,
,
故答案为:H2SO4;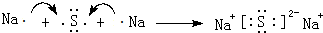 ;
;
(3)二氧化碳与过氧化钠反应生成碳酸钠与氧气,化学反应方程式为:2Na2O2+CO2=2Na2CO3+O2,
故答案为:2Na2O2+CO2=2Na2CO3+O2.
点评 本题考查结构性质位置关系应用,侧重对化学用语的考查,比较基础,注意理解掌握用电子式表示物质或化学键的形成.

练习册系列答案
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
15.下列有关阿伏伽德罗常数说法正确的是( )
| A. | 标准状况下,1.12L CCl4含有Cl原子数目为0.4 NA | |
| B. | 17g OH-所含电子数为9NA | |
| C. | 39g Na2O2与足量H2O反应,转移电子数为NA | |
| D. | 常温常压下,CO2与N2O的混合气体共44 g,其中含有的原子总数为3NA |
13.MnO2和锌是制造干电池的主要原料.
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解.
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如下(中间产物的固体部分已经略去):
 已知各种金属离子完全沉淀的pH如下表:
已知各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+
此空删去,另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用.
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解.
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如下(中间产物的固体部分已经略去):
 已知各种金属离子完全沉淀的pH如下表:
已知各种金属离子完全沉淀的pH如下表:| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+
此空删去,另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用.
20.重水(D2O)是重要的核工业原料,下列说法正确的是( )
| A. | 氘(D)的原子核外有2个电子 | |
| B. | 1H与D是同一种原子 | |
| C. | H2O与D2O互称同素异形体 | |
| D. | 1H${\;}_{2}^{18}$O与D${\;}_{2}^{16}$O的相对分子质量相同 |
17.NH3是一种重要的化工产品,是氮肥工业和制造硝酸、铵盐的重要原料: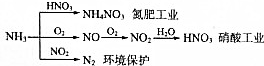
下列有关叙述错误的是( )
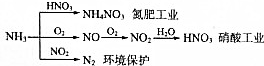
下列有关叙述错误的是( )
| A. | NH4NO3是常用化肥,在农业上用作棉花、亚麻、大麻、烟草和蔬菜等农作物的肥料,效果特别好 | |
| B. | 硝酸工业中氮元素的化合价变化情况:-3→+2→+4→+5 | |
| C. | NH3和NO2在一定条件下发生氧化还原反应,其化学方程式:8NH3+6NO2$\frac{\underline{催化剂}}{△}$7N2+12H20 | |
| D. | NH3在氮肥工业中氮元素被还原,而在硝酸工业中氮元素被氧化 |
11.浓氨水可与新制生石灰作用生成氨气,干燥的氨气在高温下能被CuO氧化成N2实验室欲用图仪器装置和药品来制取纯净的氮气.
试回答下列问题:
(1)这些装置按气流方向自左向右的连接顺序是(填A、B、C…)F→G→H→A→B→D→C(A、B顺序可颠倒).
(2)E中发生反应的化学方程式是CaO+NH3•H2O=Ca(OH)2+NH3↑.
(3)装置④中应当选用的干燥剂是(写名称)碱石灰.
(4)装置①中发生氧化还原反应的化学方程式是2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2↑3H2O+3Cu.其中氧化剂是CuO,氧化产物是N2(写化学式).
(5)装置②中浓硫酸的作用是除去水蒸气和氨气.
| 序号 | ① | ② | ③ | ④ |
| 仪器装置 | 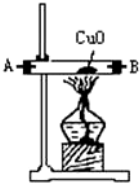 | 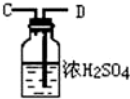 | 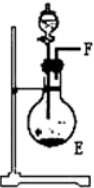 |  |
(1)这些装置按气流方向自左向右的连接顺序是(填A、B、C…)F→G→H→A→B→D→C(A、B顺序可颠倒).
(2)E中发生反应的化学方程式是CaO+NH3•H2O=Ca(OH)2+NH3↑.
(3)装置④中应当选用的干燥剂是(写名称)碱石灰.
(4)装置①中发生氧化还原反应的化学方程式是2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2↑3H2O+3Cu.其中氧化剂是CuO,氧化产物是N2(写化学式).
(5)装置②中浓硫酸的作用是除去水蒸气和氨气.
12.下列根据实验事实得出的结论错误的是( )
| 实验事实 | 结论 | |
| A | 加碱加热产生使湿润红色石蕊试纸变蓝的气体 | 溶液中含有NH4+ |
| B | 加BaCl2溶液有白色沉淀,加稀硝酸沉淀不溶解 | 该溶液中一定含有SO42- |
| C | 加KSCN溶液无现象•再滴加氯水变血红 | 溶液中有Fe2+ |
| D | 加热时.铜能与浓硫酸反应 | 浓硫酸有强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
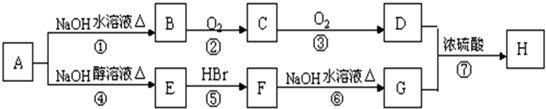
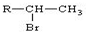 (R为烃基)
(R为烃基)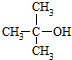 .
.