题目内容
6.元素周期表是学习化学的重要工具,它隐含许多信息和规律.请用氢、氧、钠、铝、氯五种元素回答下列相关问题.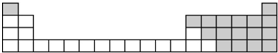
(1)用元素符号标出这些元素在周期表中对应位置(以上为周期表的一部分).
(2)上述五种元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式).
(3)写出过氧化氢的电子式
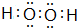 ,所含的化学键类型为共价键.
,所含的化学键类型为共价键.(4)写出氢氧化铝和氢氧化钠溶液反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
分析 (1)主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)非金属性越强,最高价氧化物对应水化物中酸性越强;
(3)过氧化氢中氧原子之间形成1对共用电子对,氧原子与H原子之间形成1对共用电子对;
(4)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水.
解答 解:(1)H原子有一个电子层、最外层电子数是1,所以位于第一周期第IA族;
O原子核外有2个电子层、最外层电子数是6,位于第二周期第VIA族;
Na原子核外有三个电子层、最外层电子数是1,所以位于第三周期第IA族;
Al原子核外有三个电子层、最外层电子数是3,所以位于第三周期第IIIA族;
Cl原子核外有3个电子层、最外层电子数是7,位于第三周期第VIIA族
所以其在周期表中的位置为 ,
,
故答案为: ;
;
(2)非金属性最强的元素是Cl元素,则酸性最强的酸是HClO4,
故答案为:HClO4;
(3)过氧化氢中氧原子之间形成1对共用电子对,氧原子与H原子之间形成1对共用电子对,电子式为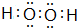 ,含有共价键,
,含有共价键,
故答案为: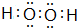 ;共价键;
;共价键;
(4)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查结构性质位置关系应用,熟练掌握周期表结构与元素周期律,注意对基础知识的理解掌握.

练习册系列答案
相关题目
16.1mol有机物甲,水解后得2molC2H6O和1molC2H2O4,该有机物是( )
| A. | CH3OOCCH2COOC2H5 | B. |  | ||
| C. | CH3COOCH2CH2COOCH3 | D. | CH3COOCH2COOC2H5 |
14.下列反应属于吸热反应的是( )
①锌粒与稀H2SO4反应制取H2
②氢气在氧气中燃烧
③碳酸钙高温分解成氧化钙和二氧化碳
④氢氧化钾和硫酸中和
⑤Ba(OH)2•8H2O与NH4Cl反应
⑥氢气还原氧化铜
⑦葡萄糖在人体内氧化分解
⑧钢铁制品生锈的反应.
①锌粒与稀H2SO4反应制取H2
②氢气在氧气中燃烧
③碳酸钙高温分解成氧化钙和二氧化碳
④氢氧化钾和硫酸中和
⑤Ba(OH)2•8H2O与NH4Cl反应
⑥氢气还原氧化铜
⑦葡萄糖在人体内氧化分解
⑧钢铁制品生锈的反应.
| A. | ①②③④ | B. | ③⑤⑥ | C. | ③⑤⑥⑦ | D. | ①②④⑧ |
1.为探究Na、Mg、Al的金属活动性顺序,某课外小组同学进行了如下实验:
他们记录的实验现象有:
请帮助该小组同学补充下列实验报告中的内容.
(1)在下表中填写与实验相对应的实验现象序号:
(2)写出钠与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(3)实验结论是金属活动性顺序为Na>Mg>Al.
(4)用原子结构理论对上述实验结论进行解释:同周期元素从左至右,原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐减小,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,因此金属性逐渐减弱.
| 实验 | ①将一小块金属钠放入滴有酚酞溶液的冷水中 ②将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液. ③将一小段镁带投入稀盐酸中 ④将一小片铝投入稀盐酸中 |
| 实验 现象 | ①剧烈反应,迅速生成大量的气体. ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红. ③反应不剧烈,产生无色气体. ④有气体产生,溶液变成红色. |
(1)在下表中填写与实验相对应的实验现象序号:
| 实验 | 1 | 2 | 3 | 4 |
| 实验现象 |
(3)实验结论是金属活动性顺序为Na>Mg>Al.
(4)用原子结构理论对上述实验结论进行解释:同周期元素从左至右,原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐减小,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,因此金属性逐渐减弱.
11.从化学的角度将下列物质进行分类,下列说法正确的是( )
| A. | 因为CO和CO2的组成元素完全相同,所以CO与CO2互为同素异形体 | |
| B. | 因为金刚石与石墨的化学式相同,所以金刚石与石墨互为同分异构体 | |
| C. | 互为同分异构体的物质具有相同的分子式 | |
| D. | 由4个氧原子构成的氧分子O4是一种新的氧化物 |
18.有机物与生产、生活密切相关.下列说法不正确的是( )
| A. | 变质的油脂有特殊难闻气味,是因为油脂发生了氧化反应 | |
| B. | 棉花的主要成分是淀粉 | |
| C. | 酒精类饮料中含有乙醇 | |
| D. | 牛奶中含有蛋白质 |
15.下列有关阿伏伽德罗常数说法正确的是( )
| A. | 标准状况下,1.12L CCl4含有Cl原子数目为0.4 NA | |
| B. | 17g OH-所含电子数为9NA | |
| C. | 39g Na2O2与足量H2O反应,转移电子数为NA | |
| D. | 常温常压下,CO2与N2O的混合气体共44 g,其中含有的原子总数为3NA |