题目内容
5.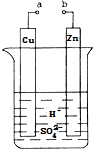 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:(1)a和b用导线连接,Cu极为原电池正极(填“正”或“负”),
(2)正极上能够观察到的现象是产生气泡,
(3)Zn极发生氧化(填“氧化”或“还原”)反应;电极反应式为Zn-2e-=Zn2+;
(4)电子的流向为Cu(用“Cu”、“Zn”表示);
(5)溶液中H+移向Cu(填“Cu”或“Zn”)极.
分析 a和b用导线连接,该装置构成原电池,锌失电子发生氧化反应而作负极,铜作正极,正极上氢离子得电子发生还原反应产生氢气,电解质溶液中阳离子向正极移动;电子由锌片经导线流下铜片,据此分析.
解答 解:a和b用导线连接,该装置构成原电池,锌失电子发生氧化反应而作负极,铜作正极,正极上氢离子得电子发生还原反应产生氢气,电解质溶液中阳离子向正极移动;电子由锌片经导线流下铜片
(1)a和b用导线连接,该装置构成原电池,铜作正极,故答案为:正;
(2)铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,故现象为产生气泡,故答案为:产生气泡;
(3)锌片为负极,失去电子发生氧化反应,电极方程式为Zn-2e-=Zn2+,故答案为:氧化;Zn-2e-=Zn2+;
(4)电子由锌片经导线流下铜片,故答案为:Cu;
(5)电解质溶液中阳离子向正极移动,故答案为:Cu.
点评 本题考查原电池原理、氧化还原反应的有关计算等知识点,明确能设计成原电池的反应特点,为易错点.

练习册系列答案
相关题目
15.乙醛(CH3CHO)、乙酸、乙酸乙酯三种有机物按一定比例组成的混合物中,若含氧的质量分数为A%,则此混合物中含氢的质量分数为( )
| A. | $\frac{6A%}{7}$ | B. | $\frac{1-A%}{7}$ | C. | $\frac{6(1-A%)}{7}$ | D. | (100-$\frac{7A}{6}$)% |
16.1mol有机物甲,水解后得2molC2H6O和1molC2H2O4,该有机物是( )
| A. | CH3OOCCH2COOC2H5 | B. |  | ||
| C. | CH3COOCH2CH2COOCH3 | D. | CH3COOCH2COOC2H5 |
10.已知元素A~E表示元素周期表中短周期的四种元素,请根据表中信息回答下列问题.
(1)A在元素周期表中的位置为第二周期第ⅣA族,元素A的一种同位素可测定文物年代,这种同位素的符号是146C.比较B、D、E的离子半径的大小S2->O2->Na+(用离子符号表示).
(2)用电子式表示元素B形成的10e-的氢化物分子的形成过程 .
.
(3)已知E在B的单质中燃烧生成淡黄色的固体,该固体化合物的电子式为 .
.
(4)C的氢化物和C的最高价氧化物的水化物反应生成甲,甲是离子化合物(填“共价化合物”或“离子化合物”),甲中的化学键类型为离子键、共价键.
(5)请写出 A的单质与D的最高价含氧酸反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(6)元素D的气态氢化物与过氧化氢溶液混合后有浅黄色固体生成,请写出发生的化学方程式H2O2+H2S=S↓+2H2O.
| 元素 | 性质或结构信息 |
| A | 组成有机物的必须元素 |
| B | 原子最外层电子数是电子层数的3倍. |
| C | 工业上通过分离液态空气获得其单质.原子的最外层电子数是内层电子总数的2.5倍. |
| D | 单质是黄色晶体,不溶于水,微溶于酒精,易溶于二硫化碳,游离态的D存在于火山喷口附近或地壳的岩层里. |
| E | 最高价氧化物的水化物能电离出与Ne电子数相等的阴阳离子. |
(2)用电子式表示元素B形成的10e-的氢化物分子的形成过程
 .
.(3)已知E在B的单质中燃烧生成淡黄色的固体,该固体化合物的电子式为
 .
.(4)C的氢化物和C的最高价氧化物的水化物反应生成甲,甲是离子化合物(填“共价化合物”或“离子化合物”),甲中的化学键类型为离子键、共价键.
(5)请写出 A的单质与D的最高价含氧酸反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(6)元素D的气态氢化物与过氧化氢溶液混合后有浅黄色固体生成,请写出发生的化学方程式H2O2+H2S=S↓+2H2O.
14.下列反应属于吸热反应的是( )
①锌粒与稀H2SO4反应制取H2
②氢气在氧气中燃烧
③碳酸钙高温分解成氧化钙和二氧化碳
④氢氧化钾和硫酸中和
⑤Ba(OH)2•8H2O与NH4Cl反应
⑥氢气还原氧化铜
⑦葡萄糖在人体内氧化分解
⑧钢铁制品生锈的反应.
①锌粒与稀H2SO4反应制取H2
②氢气在氧气中燃烧
③碳酸钙高温分解成氧化钙和二氧化碳
④氢氧化钾和硫酸中和
⑤Ba(OH)2•8H2O与NH4Cl反应
⑥氢气还原氧化铜
⑦葡萄糖在人体内氧化分解
⑧钢铁制品生锈的反应.
| A. | ①②③④ | B. | ③⑤⑥ | C. | ③⑤⑥⑦ | D. | ①②④⑧ |
15.下列有关阿伏伽德罗常数说法正确的是( )
| A. | 标准状况下,1.12L CCl4含有Cl原子数目为0.4 NA | |
| B. | 17g OH-所含电子数为9NA | |
| C. | 39g Na2O2与足量H2O反应,转移电子数为NA | |
| D. | 常温常压下,CO2与N2O的混合气体共44 g,其中含有的原子总数为3NA |
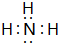 .e3z与盐酸反应生成2种盐,其中热稳定性最差的生成盐的电子式为
.e3z与盐酸反应生成2种盐,其中热稳定性最差的生成盐的电子式为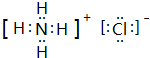 .
.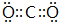 .z单质的电子式为
.z单质的电子式为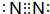 ,其结构式为N≡N.e和d形成原子个数为1:1的化合物的电子式为
,其结构式为N≡N.e和d形成原子个数为1:1的化合物的电子式为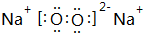 .用电子式表示x和d原子个数为1:1的化合物的形成过程
.用电子式表示x和d原子个数为1:1的化合物的形成过程 .
.