题目内容
7.在1L的密闭容器中通入2molNH3,在一定温度下发生下列反应:2NH3?N2+3H2,达到平衡时,容器内N2的体积百分含量为a%.若维持容器的体积和温度都不变,分别通入下列初始物质,达到平衡时,容器内N2的体积百分含量也为a%的是( )| A. | 3molH2+2molN2 | B. | 4molNH3 | ||
| C. | 2molN2+6molH2 | D. | 1molNH3+0.5molN2+1.5molH2 |
分析 反应2NH3?3H2+N2,在恒温恒容下,达到平衡时,容器内N2的百分含量也为a%,说明与原平衡是等效平衡,按化学计量数转化到方程式的左边,满足n(NH3)=2mol即可,据此进行分析.
解答 解:根据等效平衡,按化学计量数转化到方程式的左边,满足n(NH3)=2mol,则达到平衡时,容器内N2的百分含量为a%,
A.3molH2+2molN2按化学计量数转化到方程式的左边可得:n(NH3)=2mol、n(N2)=1mol,与原平衡不互为等效平衡,故A错误;
B.4molNH3与初始量2molNH3不相同,则不属于等效平衡,达到平衡时,容器内N2的百分含量不是a%,故B错误;
C.2molN2+6molH2按化学计量数转化到方程式的左边,n(NH3)=4mol,与初始初始加入物质不同,不是等效平衡,故C错误;
D.1molNH3+0.5molN2+1.5molH2,按化学计量数转化到方程式的左边,满足n(NH3)=2mol,属于等效平衡,故D正确;
故选D.
点评 本题考查化学平衡的有关计算,题目难度中等,正确构建平衡建立的途径是解题关键,注意掌握等效平衡的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
18.有机物与生产、生活密切相关.下列说法不正确的是( )
| A. | 变质的油脂有特殊难闻气味,是因为油脂发生了氧化反应 | |
| B. | 棉花的主要成分是淀粉 | |
| C. | 酒精类饮料中含有乙醇 | |
| D. | 牛奶中含有蛋白质 |
15.下列有关阿伏伽德罗常数说法正确的是( )
| A. | 标准状况下,1.12L CCl4含有Cl原子数目为0.4 NA | |
| B. | 17g OH-所含电子数为9NA | |
| C. | 39g Na2O2与足量H2O反应,转移电子数为NA | |
| D. | 常温常压下,CO2与N2O的混合气体共44 g,其中含有的原子总数为3NA |
2.下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是( )
①微粒半径:S2->Cl->S>Cl
②氢化物稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>Br>I.
①微粒半径:S2->Cl->S>Cl
②氢化物稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>Br>I.
| A. | ①⑤ | B. | ①③④ | C. | ②④⑥ | D. | ⑥ |
12.除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法不正确的是( )
| 选项 | 待提纯的物质 | 选用试剂 | 操作的方法 |
| A | FeCl2溶液(FeCl3溶液) | 铁粉 | 过滤 |
| B | Al2O3(Fe2O3) | NaOH溶液和CO2 | 溶解、过滤、过滤 |
| C | Cl2(HCl) | 饱和食盐水 | 洗气 |
| D | Fe(OH)3胶体(NaCl溶液) | 水 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
19.下列关于元素周期表的说法正确的是( )
| A. | ⅠA族元素也称为碱金属元素 | |
| B. | 稀有气体元素原子的最外层电子数均为8 | |
| C. | 元素周期表中最右上角元素的非金属性最强 | |
| D. | 元素周期表有18个纵行,16个族 |
17.NH3是一种重要的化工产品,是氮肥工业和制造硝酸、铵盐的重要原料: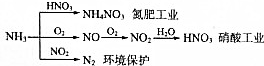
下列有关叙述错误的是( )
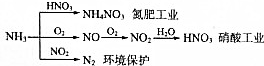
下列有关叙述错误的是( )
| A. | NH4NO3是常用化肥,在农业上用作棉花、亚麻、大麻、烟草和蔬菜等农作物的肥料,效果特别好 | |
| B. | 硝酸工业中氮元素的化合价变化情况:-3→+2→+4→+5 | |
| C. | NH3和NO2在一定条件下发生氧化还原反应,其化学方程式:8NH3+6NO2$\frac{\underline{催化剂}}{△}$7N2+12H20 | |
| D. | NH3在氮肥工业中氮元素被还原,而在硝酸工业中氮元素被氧化 |