题目内容
9.下列实验操作不能达到实验目的是( )| A. | 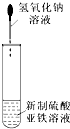 可以制备Fe(OH)2并可以较长时间观察到Fe(OH)2的颜色 | |
| B. | 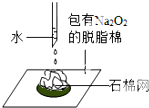 可以证明过氧化钠与水反应是放热反应 | |
| C. | 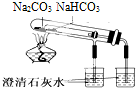 可以证明碳酸钠热稳定性比碳酸氢钠好 | |
| D. | 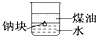 可以证明密度:ρ(煤油)<ρ(钠)<ρ(水) |
分析 A.Fe(OH)2易被空气中的氧气氧化;
B.反应放出的热量能使脱脂棉燃烧;
C.碳酸氢钠不稳定加热分解,而碳酸钠不分解;
D.钠位于水和煤油之间.
解答 解:A.Fe(OH)2易被空气中的氧气氧化,应隔绝空气制取,故A错误;
B.反应放出的热量能使脱脂棉燃烧,可证明,故B正确;
C.碳酸氢钠不稳定加热分解,而碳酸钠不分解,则图中小试管中温度低碳酸氢钠分解,可知碳酸氢钠的稳定性差,故C正确;
D.钠位于水和煤油之间,可以证明密度:ρ(煤油)<ρ(钠)<ρ(水),故D正确.
故选A.
点评 本题考查较为综合,涉及物质的制备、元素及其化合物的性质实验等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大.

练习册系列答案
相关题目
3.下列关于石油的说法正确的是( )
| A. | 石油裂解的目的主要是为了把重油分解成相对分子量较小的烃 | |
| B. | 石油裂解可以得到氯乙烯 | |
| C. | 石油分馏能得到不同沸点范围的产物 | |
| D. | 石油裂化是物理变化 |
4.把铁、氧化铁、氧化铜的混合物粉末放入1L 5mol•L-1盐酸中,充分反应后产生13.44L H2(标准状况),残留固体32g.过滤,滤液中无Cu2+.将滤液加水稀释到2L,测得其中c(H+)为0.2mol•L-1,则原混合物的总质量为( )
| A. | 216g | B. | 188g | C. | 180g | D. | 148g |
17.短周期元素X、Y、Z、W、Q在周期表中的相对位置如图所示.下列说法不正确的是( )
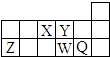

| A. | 离子半径的大小顺序为W>Q>Y>Z | |
| B. | X、Y、W三种元素的非金属性大小顺序为X>Y>W | |
| C. | X、Z、W三种元素的最高价氧化物对应的水化物均能与强碱反应 | |
| D. | 元素X的最简单氢化物与Q的氢化物化合的产物中既含共价键又含离子键 |
4.根据下列反应判断有关物质还原性由强到弱的顺序是( )
①H2SO3+I2+H2O═2HI+H2SO4
②2FeCl3+2HI═2FeCl2+2HCl+I2
③3FeCl2+4HNO3═2FeCl3+NO↑+Fe(NO3)3+2H2O.
①H2SO3+I2+H2O═2HI+H2SO4
②2FeCl3+2HI═2FeCl2+2HCl+I2
③3FeCl2+4HNO3═2FeCl3+NO↑+Fe(NO3)3+2H2O.
| A. | H2SO3>I->Fe2+>NO | B. | I->Fe2+>H2SO3>NO | ||
| C. | Fe2+>I->H2SO3>NO | D. | NO>Fe2+>H2SO3>I- |
1.一种新催化剂能在室温下催化空气氧化甲醛:HCHO+O2→CO2+H2O,该反应( )
| A. | 反应物和生成物均为分子晶体 | |
| B. | 反应物和生成物都为直线型分子 | |
| C. | 反应时旧键断裂放出能量,新键形成吸收能量 | |
| D. | 产物中CO2的键能大于H2O,所以沸点高于H2O |
18.下列各组物质均属于分子晶体且均为化合物的是( )
| A. | NH3、HD、C10H8 | B. | PCl3、CO2、AlCl3 | C. | SO2、SiO2、P2O5 | D. | CCl4、H2O2、Na2S |