题目内容
4.把铁、氧化铁、氧化铜的混合物粉末放入1L 5mol•L-1盐酸中,充分反应后产生13.44L H2(标准状况),残留固体32g.过滤,滤液中无Cu2+.将滤液加水稀释到2L,测得其中c(H+)为0.2mol•L-1,则原混合物的总质量为( )| A. | 216g | B. | 188g | C. | 180g | D. | 148g |
分析 混合物与盐酸反应生成氯化物、氢气与水,滤液中还有较多H+离子剩余,且滤液中没有Cu2+,可知残留物没有Fe,只有Cu,而Cu可以残留说明溶液中没有Fe3+,溶液中阳离子为H+和Fe2+,根据电荷守恒计算n(Fe2+),根据原子守恒计算混合物中Fe元素质量,参加反应的HCl中的H元素转化到氢气、水中,根据H原子守恒计算混合物中O原子物质的量,进而计算O元素质量,Cu、Fe、O氧元素质量之和为混合物总质量.
解答 解:混合物与盐酸反应生成氯化物、氢气与水,滤液中还有较多H+离子剩余,且滤液中没有Cu2+,可知残留物没有Fe,只有Cu,即32g为Cu的质量,而Cu可以残留说明溶液中没有Fe3+,溶液中阳离子为H+和Fe2+,
反应后剩余n(H+)=0.2mol•L-1×2L=0.4mol,溶液中氯离子不变,则n(Cl-)=5mol•L-1×1L=5mol,根据电荷守恒:2n(Fe2+)=n(Cl-)-n(H+)=5mol-0.4mol=4.6mol,则n(Fe2+)=2.3mol,根据原子守恒可知,混合物中Fe元素质量=2.3mol×56g/mol=128.8g,
参加反应的HCl中的H元素转化到氢气、水中,根据H原子守恒,2n(H2O)+2n(H2)=n总(HCl)-n余(H+),即2n(H2O)+2×$\frac{13.44L}{22.4L/mol}$=5mol-0.4mol,n(H2O)=1.7mol,故混合物中氧元素质量=1.7mol×16g/mol=27.2g,
故原混合物总质量=32g+128.8g+27.2g=188g,
故选B.
点评 本题考查混合物计算,本题注意从溶液存在的离子判断物质反应的程度,利用守恒的方法计算,题目难度中等.

练习册系列答案
相关题目
14.能用H++OH-=H2O表示的是( )
| A. | NaOH溶液和CO2的反应 | B. | Cu(OH)2和稀H2S04的反应 | ||
| C. | Ba(OH)2溶液和盐酸反应 | D. | CaC03和稀H2S04的反应 |
15.生活处处有化学,下列说法正确的是( )
| A. | 家里用的金龙鱼油和猪油都是可皂化的饱和酯类 | |
| B. | 亲购买保温杯时可选购304不锈钢材质的,这种材料耐高温,韧性好,这是一种合金 | |
| C. | 做衣服用的棉和麻均与淀粉互为同分异构体 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
12.下列反应属于放热反应的是( )
| A. | 破坏生成物全部化学键所需能量小于破坏反应物全部化学键所需能量 | |
| B. | HCO3-+H2O?CO32-+H3O+ | |
| C. | HCO3-+H2O?H2CO3+OH- | |
| D. | CH3COOH+KOH?CH3COOK+H2O |
19.洗涤下列试管时,选用的试剂(括号中物质)不妥当的是( )
| A. | 做过KMn04分解反应实验的试管(浓盐酸) | |
| B. | 做过木炭还原氧化铜实验的试管(硝酸) | |
| C. | 做过银镜反应实验的试管(氨水) | |
| D. | 做过Na2S2O3与稀硫酸反应的试管(二硫化碳) |
5.NA代表阿伏伽德罗常数.已知C2H4和C3H6的混合物的质量为m g,则该混合物( )
| A. | 所含碳原子总数为$\frac{m{N}_{A}}{14}$ | |
| B. | 所含碳氢键数目为$\frac{3m{N}_{A}}{14}$ | |
| C. | 所含共用电子对数目为($\frac{m}{14}$+1)NA | |
| D. | 完全燃烧时消耗的O2一定是 $\frac{33.6m}{14}$L |
9.下列实验操作不能达到实验目的是( )
| A. | 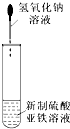 可以制备Fe(OH)2并可以较长时间观察到Fe(OH)2的颜色 | |
| B. | 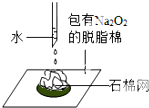 可以证明过氧化钠与水反应是放热反应 | |
| C. | 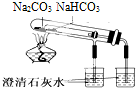 可以证明碳酸钠热稳定性比碳酸氢钠好 | |
| D. | 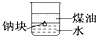 可以证明密度:ρ(煤油)<ρ(钠)<ρ(水) |
10.下列图示的四种实验操作名称从左到右依次是( )


| A. | 过滤、蒸发、蒸馏、萃取分液 | B. | 过滤、蒸馏、蒸发、萃取分液 | ||
| C. | 蒸发、蒸馏、过滤、萃取分液 | D. | 萃取分液、蒸馏、蒸发、过滤 |