题目内容
17.短周期元素X、Y、Z、W、Q在周期表中的相对位置如图所示.下列说法不正确的是( )
| A. | 离子半径的大小顺序为W>Q>Y>Z | |
| B. | X、Y、W三种元素的非金属性大小顺序为X>Y>W | |
| C. | X、Z、W三种元素的最高价氧化物对应的水化物均能与强碱反应 | |
| D. | 元素X的最简单氢化物与Q的氢化物化合的产物中既含共价键又含离子键 |
分析 由短周期元素X、Y、Z、W、Q在元素周期表中的相对位置,可知X为N,Y为O,Z为Al,W为S,Q为Cl.
A.电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大;
B.同周期自左而右元素非金属性增强;
C.X、Z、W元素的最高价氧化物对应水化物分别为硝酸、氢氧化铝、硫酸,均能与碱反应;
D.元素X的氢化物与Q的氢化物化合的产物是氯化铵.
解答 解:由短周期元素X、Y、Z、W、Q在元素周期表中的相对位置,可知X为N,Y为O,Z为Al,W为S,Q为Cl.
A.电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:r(S2-)>r(Cl-)>r(O2-)>r(Al3+),故A正确;
B.同周期自左而右元素非金属性增强,则非金属性Y>X,故B错误;
C.X、W元素的最高价氧化物对应水化物分别为硝酸、硫酸,能与碱反应,Z元素的最高价氧化物对应水化物为氢氧化铝,属于两性氢氧化物,能与强碱反应,故C正确;
D.元素X的氢化物与Q的氢化物化合的产物是氯化铵,含有离子键、共价键,故D正确,
故选B.
点评 本题考查元素周期表与元素周期律,注意把握元素周期律和元素性质的递变规律,理解掌握离子半径的比较规律.

练习册系列答案
相关题目
11.6.4g 铜与一定量硝酸充分反应后,硝酸的还原产物是NO,反应后溶液中所含 H+为 n mol,此时溶液中所含 NO3-物质的量为( )
| A. | 0.28 mol | B. | 0.31 mol | C. | (n+0.2)mol | D. | (n+0.4)mol |
12.下列反应属于放热反应的是( )
| A. | 破坏生成物全部化学键所需能量小于破坏反应物全部化学键所需能量 | |
| B. | HCO3-+H2O?CO32-+H3O+ | |
| C. | HCO3-+H2O?H2CO3+OH- | |
| D. | CH3COOH+KOH?CH3COOK+H2O |
5.NA代表阿伏伽德罗常数.已知C2H4和C3H6的混合物的质量为m g,则该混合物( )
| A. | 所含碳原子总数为$\frac{m{N}_{A}}{14}$ | |
| B. | 所含碳氢键数目为$\frac{3m{N}_{A}}{14}$ | |
| C. | 所含共用电子对数目为($\frac{m}{14}$+1)NA | |
| D. | 完全燃烧时消耗的O2一定是 $\frac{33.6m}{14}$L |
2.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 一定条件下,1 mol N2与足量H2反应生成NH3,转移电子6NA | |
| C. | pH=13的氢氧化钠溶液中所含Na+为0.1NA | |
| D. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
9.下列实验操作不能达到实验目的是( )
| A. | 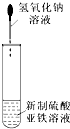 可以制备Fe(OH)2并可以较长时间观察到Fe(OH)2的颜色 | |
| B. | 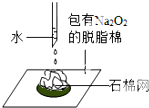 可以证明过氧化钠与水反应是放热反应 | |
| C. | 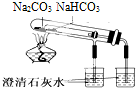 可以证明碳酸钠热稳定性比碳酸氢钠好 | |
| D. | 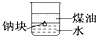 可以证明密度:ρ(煤油)<ρ(钠)<ρ(水) |
6.NA表示阿伏加德罗常数.下列说法正确的是( )
| A. | 标准状态下,33.6 L氟化氢中含有1.5 NA个氟化氢分子 | |
| B. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| C. | 1molNaCl晶体中含有NA个Na+ | |
| D. | 28g乙烯分子中含有极性共价键的数目为6NA |
7.下列离子方程式正确的是( )
| A. | 硫化钠水解:S2-+2H2O?H2S+2OH- | |
| B. | 硫氢化钠的水解:HS-+H2O?H3O++S2- | |
| C. | 不断加热煮沸氯化铁溶液:Fe3++3H2O?Fe(OH)3+3H+ | |
| D. | NH4Cl水解:NH4++H2O?NH3•H2O+H+ |