题目内容
4.根据下列反应判断有关物质还原性由强到弱的顺序是( )①H2SO3+I2+H2O═2HI+H2SO4
②2FeCl3+2HI═2FeCl2+2HCl+I2
③3FeCl2+4HNO3═2FeCl3+NO↑+Fe(NO3)3+2H2O.
| A. | H2SO3>I->Fe2+>NO | B. | I->Fe2+>H2SO3>NO | ||
| C. | Fe2+>I->H2SO3>NO | D. | NO>Fe2+>H2SO3>I- |
分析 利用化合价变化来判断还原剂,并利用还原剂的还原性大于还原产物的还原性来比较还原性的强弱.
解答 解:①H2SO3+I2+H2O=2HI+H2SO4中,I元素的化合价降低,S元素的化合价升高,则H2SO3为还原剂,还原性H2SO3>I-,
②2FeCl3+2HI=2FeCl2+2HCl+I2中,Fe元素的化合价降低,I元素的化合价升高,则HI为还原剂,还原性I->Fe2+,
③3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3中,N元素的化合价降低,Fe元素的化合价升高,则FeCl2为还原剂,还原性Fe2+>NO,
显然还原性由强到弱的顺序为H2SO3>I->Fe2+>NO,
故选A.
点评 本题考查氧化还原反应中还原性的比较,能利用化合价分析氧化还原反应,利用氧化还原反应中的规律来比较还原性是解答本题的关键.

练习册系列答案
相关题目
18.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为8NA | |
| C. | 0.5 摩1,3-丁二烯分子中含有C=C双键数为 NA | |
| D. | 1 mol碳正离子(CH3+)所含的电子总数为8NA |
19.洗涤下列试管时,选用的试剂(括号中物质)不妥当的是( )
| A. | 做过KMn04分解反应实验的试管(浓盐酸) | |
| B. | 做过木炭还原氧化铜实验的试管(硝酸) | |
| C. | 做过银镜反应实验的试管(氨水) | |
| D. | 做过Na2S2O3与稀硫酸反应的试管(二硫化碳) |
19.下列有关说法正确的是( )
| A. | 在任何条件下,纯水都呈中性 | |
| B. | 电离平衡常数Ka越小,表示弱电解质电离能力越强 | |
| C. | 为保存FeCl3溶液,要在溶液中加少量硫酸 | |
| D. | 明矾溶液蒸干得到的固体为Al(OH)3 |
9.下列实验操作不能达到实验目的是( )
| A. | 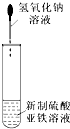 可以制备Fe(OH)2并可以较长时间观察到Fe(OH)2的颜色 | |
| B. | 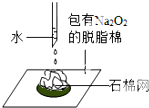 可以证明过氧化钠与水反应是放热反应 | |
| C. | 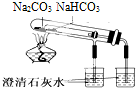 可以证明碳酸钠热稳定性比碳酸氢钠好 | |
| D. | 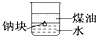 可以证明密度:ρ(煤油)<ρ(钠)<ρ(水) |
16.pH=12的NaOH溶液和pH=10的NaOH溶液等体积混合后溶液的( )
| A. | pH=11 | B. | pH=10.3 | ||
| C. | c(H+)=2×10-12 mol•L-1 | D. | c(H+)=(10-12+10-10)/2 mol•L-1 |
13.下列说法正确的是( )
| A. | 有机物CH3C(CH3)3的系统命名为2,2-二甲基新戊烷 | |
| B. | 樱桃是一种抗氧化的水果,樱桃中含有一种羟基酸,如图所示 ,通常条件下,该羟基酸可以发生取代、氧化和加成反应 ,通常条件下,该羟基酸可以发生取代、氧化和加成反应 | |
| C. | 涤纶是由对苯二甲酸(PTA)和乙二醇(EG)通过加聚反应得到的 | |
| D. | 等质量的甲醛和乙酸充分燃烧耗氧量相同 |