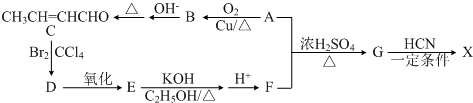
题目内容
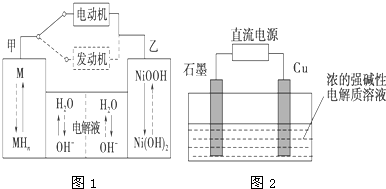 运用相关原理,回答下列问题:
运用相关原理,回答下列问题:(1)已知:
①Fe(s)+
| 1 |
| 2 |
②2Al(s)+
| 3 |
| 2 |
Al和FeO发生铝热反应的热化学方程式是
(2)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理示意如图1,其总反应式为H2+2NiOOH
| 放电 |
| 充电 |
(3)Cu2O是一种半导体材料,可通过如图2所示的电解装置制取,电解总反应式为2Cu+H2O
| ||
(4)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的
考点:用盖斯定律进行有关反应热的计算,金属的电化学腐蚀与防护,化学电源新型电池
专题:化学反应中的能量变化,电化学专题
分析:(1)依据题干热化学方程式结合盖斯定律写出该热化学反应方程式;现实制取金属时表现考虑生成成本;
(2)该装置是原电池,根据图知,乙是镍的化合物为正极,正极上NiOOH得电子发生还原反应,根据乙电极上电极反应式判断pH值的变化;
(3)在电解池中,阴极是阳离子发生得电子得还原反应,根据电子守恒来计算氢气消耗量和Cu2O的理论产量之间的关系;
(4)钢铁船体在海水中易发生电化学腐蚀中的吸氧腐蚀,在电解池中,阴极是被保护的电极.
(2)该装置是原电池,根据图知,乙是镍的化合物为正极,正极上NiOOH得电子发生还原反应,根据乙电极上电极反应式判断pH值的变化;
(3)在电解池中,阴极是阳离子发生得电子得还原反应,根据电子守恒来计算氢气消耗量和Cu2O的理论产量之间的关系;
(4)钢铁船体在海水中易发生电化学腐蚀中的吸氧腐蚀,在电解池中,阴极是被保护的电极.
解答:
解:(1)①Fe(s)+
O2(g)═FeO(s)△H1=-272.0kJ?mol-1;
②2Al(s)+
O2(g)═Al2O3(s)△H2=-1 675.7kJ?mol-1
根据盖斯定律,将方程式②-①×3得:2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ?mol-1;
利用铝热反应在工业上大量炼铁时,需要消耗冶炼成本更高的Al,导致冶炼Fe的成本过高,所以不能用该反应原理进行工业炼铁,
故答案为:2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ?mol-1;不能;该反应消耗大量能量,成本较高;
(2)该装置是原电池,根据图知,乙才镍的化合物为正极,正极上NiOOH和水得电子生成氢氧化镍和氢氧根离子,电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,所以氢氧根离子浓度增大,pH值变大,
故答案为:增大;NiOOH+H2O+e-=Ni(OH)2+OH-;
(3)在电解池中,阴极是阳离子氢离子发生得电子得还原反应,即2H++2e-=H2↑,根据电子守恒,当蓄电池中有1mol H2被消耗时,转移电子是2mol,当转移2mol电子时,根据电解反应:2Cu+H2O
Cu2O+H2,Cu2O的生成量为1mol,质量为144g,
故答案为:2H++2e-=H2↑;144;
(4)钢铁船体在海水中易发生电化学腐蚀中的吸氧腐蚀,在电解池中,阴极是被保护的电极,可以把船体与浸在海水里的Zn块相连,并与电源的负极相连,
故答案为:吸氧;负.
| 1 |
| 2 |
②2Al(s)+
| 3 |
| 2 |
根据盖斯定律,将方程式②-①×3得:2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ?mol-1;
利用铝热反应在工业上大量炼铁时,需要消耗冶炼成本更高的Al,导致冶炼Fe的成本过高,所以不能用该反应原理进行工业炼铁,
故答案为:2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ?mol-1;不能;该反应消耗大量能量,成本较高;
(2)该装置是原电池,根据图知,乙才镍的化合物为正极,正极上NiOOH和水得电子生成氢氧化镍和氢氧根离子,电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,所以氢氧根离子浓度增大,pH值变大,
故答案为:增大;NiOOH+H2O+e-=Ni(OH)2+OH-;
(3)在电解池中,阴极是阳离子氢离子发生得电子得还原反应,即2H++2e-=H2↑,根据电子守恒,当蓄电池中有1mol H2被消耗时,转移电子是2mol,当转移2mol电子时,根据电解反应:2Cu+H2O
| ||
故答案为:2H++2e-=H2↑;144;
(4)钢铁船体在海水中易发生电化学腐蚀中的吸氧腐蚀,在电解池中,阴极是被保护的电极,可以把船体与浸在海水里的Zn块相连,并与电源的负极相连,
故答案为:吸氧;负.
点评:本题考查了盖斯定律在热化学方程式中的应用、原电池工作原理及其应用方法、金属的腐蚀与防护等知识,题目难度中等,试题涉及的知识点较多、题量较大,充分考查了学生对所学知识的掌握情况.

练习册系列答案
相关题目
下列关于盖斯定律描述不正确的是( )
| A、化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关 |
| B、盖斯定律遵守能量守恒定律 |
| C、利用盖斯定律可间接计算通过实验难测定的反应的反应热 |
| D、利用盖斯定律可以计算有副反应发生的反应的反应热 |
向AgCl饱和溶液中滴加足量NaBr溶液,产生淡黄色沉淀,再向溶液中滴加KI溶液又产生黄色沉淀.有关下列说法正确的是( )
| A、产生的淡黄色沉淀为AgI |
| B、产生的黄色沉淀为AgBr |
| C、由上述实验现象可说明溶解度S(AgBr)>S(AgI)>S(AgCl) |
| D、上述实验理解说明沉淀可相互转化 |
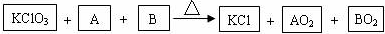
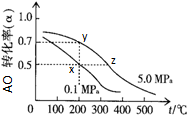

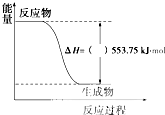 (1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
(1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题: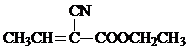 )是合成某种手术用粘合剂的单体,X的合成路线如下:
)是合成某种手术用粘合剂的单体,X的合成路线如下: