��Ŀ����
��ҵ������N2��H2���Ժϳ�NH3��NH3�ֿ��Խ�һ���Ʊ�������N2H4���ȣ�
��1���������N2H4��ȼ�ϣ�N2O4������������֪��
N2��g��+2O2��g��=2NO2��g����H=+67.7kJ?mol-1
N2H4��g��+O2��g��=N2��g��+2H2O��g����H=-534.0kJ?mol-1
NO2��g��?
N2O4��g����H=-26.35kJ?mol-1
��д����̬��������̬������������ȼ�����ɵ�������̬ˮ���Ȼ�ѧ����ʽ�� ��
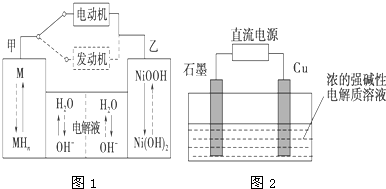
��2���縡ѡ���۷��ǹ�ҵ�ϲ��õ�һ����ˮ����������ͨ���������Fe��OH��3������Fe��OH��3������������������������о���ˮ�����ã��������������ݰ���ˮ�����������ˮ���γɸ����㣬Ʋ�������㣬�����˸�ѡ���������ã�ijС���õ縡ѡ���۷�������ˮ�����װ����ͼ1��ʾ��

��д��ͼ1�м���������ȼ�ϵ�ظ����ĵ缫��Ӧʽ ��
��ͼ1�е������������������缫��Ӧ���缫��Ӧʽ�ֱ��� �� ��
��3����һ�������£���1mol N2��3mol H2�����һ��10L�ܱ������У���Ӧ�ڲ�ͬ�¶��´ﵽƽ��ʱNH3��Ũ����ͼ2��ʾ��
���������ж�������Ӧ��һ���¶�ʱ�ﵽ��ѧƽ��״̬���ǣ�����ĸ����
a��3c��N2��=c��H2��
b��3v����N2��=v����H2��
c�������е�ѹǿ����
d��1mol N��N�����ѵ�ͬʱ����2mol H-N��
�ڵ��¶���T1�仯��T2ʱ����ӦN2��g��+3H2��g��?2NH3��g��ƽ�ⳣ��KA KB�����������������=����
�۷�ӦN2��g��+3H2��g��?2NH3��g����ƽ�ⳣ��K=���г�����ʽ�����¶�ΪT1ʱ����ƽ���������а����������Ϊ25%����ﵽƽ��ʱN2��ת����Ϊ ��
��1���������N2H4��ȼ�ϣ�N2O4������������֪��
N2��g��+2O2��g��=2NO2��g����H=+67.7kJ?mol-1
N2H4��g��+O2��g��=N2��g��+2H2O��g����H=-534.0kJ?mol-1
NO2��g��?
| 1 |
| 2 |
��д����̬��������̬������������ȼ�����ɵ�������̬ˮ���Ȼ�ѧ����ʽ��
��2���縡ѡ���۷��ǹ�ҵ�ϲ��õ�һ����ˮ����������ͨ���������Fe��OH��3������Fe��OH��3������������������������о���ˮ�����ã��������������ݰ���ˮ�����������ˮ���γɸ����㣬Ʋ�������㣬�����˸�ѡ���������ã�ijС���õ縡ѡ���۷�������ˮ�����װ����ͼ1��ʾ��

��д��ͼ1�м���������ȼ�ϵ�ظ����ĵ缫��Ӧʽ
��ͼ1�е������������������缫��Ӧ���缫��Ӧʽ�ֱ���
��3����һ�������£���1mol N2��3mol H2�����һ��10L�ܱ������У���Ӧ�ڲ�ͬ�¶��´ﵽƽ��ʱNH3��Ũ����ͼ2��ʾ��
���������ж�������Ӧ��һ���¶�ʱ�ﵽ��ѧƽ��״̬���ǣ�����ĸ����
a��3c��N2��=c��H2��
b��3v����N2��=v����H2��
c�������е�ѹǿ����
d��1mol N��N�����ѵ�ͬʱ����2mol H-N��
�ڵ��¶���T1�仯��T2ʱ����ӦN2��g��+3H2��g��?2NH3��g��ƽ�ⳣ��KA
�۷�ӦN2��g��+3H2��g��?2NH3��g����ƽ�ⳣ��K=���г�����ʽ�����¶�ΪT1ʱ����ƽ���������а����������Ϊ25%����ﵽƽ��ʱN2��ת����Ϊ
���㣺�ø�˹���ɽ����йط�Ӧ�ȵļ���,��ѧ��Դ���͵��,��ѧƽ��״̬���ж�,��ѧƽ��ļ���
ר�⣺��ѧ��Ӧ�е������仯,��ѧƽ��ר��,�绯ѧר��
��������1�����ݸ�˹���ɣ�����֪�Ȼ�ѧ����ʽ���Ժ��ʵ�ϵ�������ʵ��ļӼ�����Ӧ��Ҳ������Ӧ��ϵ��������Ӧ�ļӼ���
��2����ȼ�ϵ���У����������ķ�Ӧ��ȼ��ʧ���ӱ������Ĺ��̣�
�ڸ��ݵ缫���Ϻ����ӵķŵ�˳���ǣ�
��3���٣���a��3c��N2��=c��H2����������˵��Ũ�Ȳ��ٷ����ı䣬��˲���˵���ﵽ��ѧƽ�⣻
b��3v����N2��=v����H2���������淴Ӧ��ѧ��Ӧ������ȣ�˵������ƽ��״̬��
c���÷�Ӧ����һ��������ķ�Ӧ�������е�ѹǿ���䣬˵���÷�Ӧ���ڻ�ѧƽ��״̬��
d��1mol N��N�����ѵ�ͬʱ����6mol H-N���������淴Ӧ��ѧ��Ӧ������ȣ�˵������ƽ��״̬��
�ڸ÷�Ӧ�Ƿ��ȵģ��¶�Խ�ߣ�ƽ�������ƶ���KԽС��
�۸�������ʽ����ת���ʣ�
��2����ȼ�ϵ���У����������ķ�Ӧ��ȼ��ʧ���ӱ������Ĺ��̣�
�ڸ��ݵ缫���Ϻ����ӵķŵ�˳���ǣ�
��3���٣���a��3c��N2��=c��H2����������˵��Ũ�Ȳ��ٷ����ı䣬��˲���˵���ﵽ��ѧƽ�⣻
b��3v����N2��=v����H2���������淴Ӧ��ѧ��Ӧ������ȣ�˵������ƽ��״̬��
c���÷�Ӧ����һ��������ķ�Ӧ�������е�ѹǿ���䣬˵���÷�Ӧ���ڻ�ѧƽ��״̬��
d��1mol N��N�����ѵ�ͬʱ����6mol H-N���������淴Ӧ��ѧ��Ӧ������ȣ�˵������ƽ��״̬��
�ڸ÷�Ӧ�Ƿ��ȵģ��¶�Խ�ߣ�ƽ�������ƶ���KԽС��
�۸�������ʽ����ת���ʣ�
���
�⣺��1����֪����N2��g��+2O2��g��=2NO2��g����H=+67.7kJ?mol-1
��N2H4��g��+O2��g��=N2��g��+2H2O��g����H=-534.0kJ?mol-1
��NO2��g��?
N2O4��g����H=-26.35kJ?mol-1
���ݸ�˹���ɣ��ڡ�2-��-�ۡ�2��2N2H4��g��+N2O4��g��=3N2��g��+4H2O��g����
�ʡ�H=2����-534.0kJ?mol-1��-67.7kJ?mol-1-2����-26.35kJ?mol-1��=-1083kJ?mol-1��
���Ȼ�ѧ����ʽΪ2N2H4��g��+N2O4��g��=3N2��g��+4H2O��g����H=-1083kJ?mol-1��
�ʴ�Ϊ��2N2H4��g��+N2O4��g��=3N2��g��+4H2O��g����H=-1083kJ?mol-1��
��2���ٸ�����Ӧ��CH4ʧ���ӣ��õ�صĵ���ʻ���������̼���Σ����Ը�����ӦΪ��CH4+4CO32--8e-=5CO2+2H2O��
�ʴ�Ϊ��CH4+4CO32--8e-=5CO2+2H2O��
�ڵ��ʱ���������������Ҫ����Fe-2e-=Fe2+��ͬʱҲ��������Ӧ������Һ�е�OH-ʧ���ӱ���������O2���缫��ӦʽΪ4OH--4 e-=2H2O+O2����
�ʴ�Ϊ��Fe-2e-=Fe2+��2H2O-4e-=4H++O2����
��3����a��3c��N2��=c��H2����������˵��Ũ�Ȳ��ٷ����ı䣬��˲���˵���ﵽ��ѧƽ�⣻
b��3v����N2��=v����H2���������淴Ӧ��ѧ��Ӧ������ȣ�˵������ƽ��״̬��
c���÷�Ӧ����һ��������ķ�Ӧ�������е�ѹǿ���䣬˵���÷�Ӧ���ڻ�ѧƽ��״̬��
d��1mol N��N�����ѵ�ͬʱ����6mol H-N���������淴Ӧ��ѧ��Ӧ������ȣ�˵������ƽ��״̬��
��ѡbc��
�ڸ÷�Ӧ�Ƿ��ȵģ��¶�Խ�ߣ�ƽ�������ƶ���KԽС������KA��KB��
�ʴ�Ϊ������
�۽�l mol N2��3mol H2�����һ��10L�ܱ������У���Ӧ�ﵽƽ��ʱ��A���������а��İٷֺ�����25%���赪����ת������x����
N2+3H2�T2NH3
��ʼŨ�ȣ�0.1 0.3 0
�仯Ũ�ȣ�x 3x 2x
ĩ̬Ũ�ȣ�0.1-x 0.3-3x 2x
��
��100%=25%�����x=0.04mol/L��
���Ե�����ת������
��100%=40%��
�ʴ�Ϊ��40%��
��N2H4��g��+O2��g��=N2��g��+2H2O��g����H=-534.0kJ?mol-1
��NO2��g��?
| 1 |
| 2 |
���ݸ�˹���ɣ��ڡ�2-��-�ۡ�2��2N2H4��g��+N2O4��g��=3N2��g��+4H2O��g����
�ʡ�H=2����-534.0kJ?mol-1��-67.7kJ?mol-1-2����-26.35kJ?mol-1��=-1083kJ?mol-1��
���Ȼ�ѧ����ʽΪ2N2H4��g��+N2O4��g��=3N2��g��+4H2O��g����H=-1083kJ?mol-1��
�ʴ�Ϊ��2N2H4��g��+N2O4��g��=3N2��g��+4H2O��g����H=-1083kJ?mol-1��
��2���ٸ�����Ӧ��CH4ʧ���ӣ��õ�صĵ���ʻ���������̼���Σ����Ը�����ӦΪ��CH4+4CO32--8e-=5CO2+2H2O��
�ʴ�Ϊ��CH4+4CO32--8e-=5CO2+2H2O��
�ڵ��ʱ���������������Ҫ����Fe-2e-=Fe2+��ͬʱҲ��������Ӧ������Һ�е�OH-ʧ���ӱ���������O2���缫��ӦʽΪ4OH--4 e-=2H2O+O2����
�ʴ�Ϊ��Fe-2e-=Fe2+��2H2O-4e-=4H++O2����
��3����a��3c��N2��=c��H2����������˵��Ũ�Ȳ��ٷ����ı䣬��˲���˵���ﵽ��ѧƽ�⣻
b��3v����N2��=v����H2���������淴Ӧ��ѧ��Ӧ������ȣ�˵������ƽ��״̬��
c���÷�Ӧ����һ��������ķ�Ӧ�������е�ѹǿ���䣬˵���÷�Ӧ���ڻ�ѧƽ��״̬��
d��1mol N��N�����ѵ�ͬʱ����6mol H-N���������淴Ӧ��ѧ��Ӧ������ȣ�˵������ƽ��״̬��
��ѡbc��
�ڸ÷�Ӧ�Ƿ��ȵģ��¶�Խ�ߣ�ƽ�������ƶ���KԽС������KA��KB��
�ʴ�Ϊ������
�۽�l mol N2��3mol H2�����һ��10L�ܱ������У���Ӧ�ﵽƽ��ʱ��A���������а��İٷֺ�����25%���赪����ת������x����
N2+3H2�T2NH3
��ʼŨ�ȣ�0.1 0.3 0
�仯Ũ�ȣ�x 3x 2x
ĩ̬Ũ�ȣ�0.1-x 0.3-3x 2x
��
| 2x |
| 0.1-x+0.3-3x+2x |
���Ե�����ת������
| 0.04mol/L |
| 0.1mol/L |
�ʴ�Ϊ��40%��
�����������ۺϿ������йص绯ѧ����ѧ��Ӧ���ʺ�ƽ����йؼ����֪ʶ���ۺ��Խ�ǿ���Ѷȴ���ʱע���������η��������������ݹ�ϵ��

��ϰ��ϵ�д�
 ��У����ϵ�д�
��У����ϵ�д�
�����Ŀ
����˵����ȷ���ǣ�������
| A���ܶȻ������ܽ�ƽ��ʱ���ܵ��������Һ�еĸ�����Ũ�ȵij˻� |
| B���ܶȻ������Dz����κ�����Ӱ��ij���������ܶȻ� |
| C���������ӻ�Qc�жϳ����ܽ�ƽ����еķ��� |
| D���������ʵ��ܶȻ��������¶ȵ����߶������ |
ij����С��Ϊ̽��BaSO4���ܽ�ȣ��ֱ�����BaSO4���룺��5mLˮ ��20mL 0.5mol?L-1��Na2SO4��Һ ��40mL 0.2mol?L-1��Ba��OH��2��Һ ��40mL 0.1mol?L-1��H2SO4��Һ�У��ܽ������ͣ����ϸ���Һ�У�c��Ba2+���Ĵ�С˳����ȷ���ǣ�������
| A���ۣ��٣��ܣ��� |
| B���ۣ��٣��ڣ��� |
| C���٣��ܣ��ۣ��� |
| D���٣��ۣ��ܣ��� |
��һ�������£���3molSO2��2molO2��4molSO3�������������һ���Ϊ2L���ܱ������г�ַ�Ӧ��10min��Ӧ�ﵽƽ�⣮��֪���ʱ����v��SO2��=0.02mol/��L?min���������ʱ����SO3�����ʵ���Ũ�ȿ���Ϊ��������
| A��6mol/L |
| B��3mol/L |
| C��2mol/L |
| D��1mol/L |
������ȷ���ǣ�������
| A����һ��������ͨ��0.1 mol?L-1 NH4Cl��Һ�п����У�c��NH4+����c��Cl-����c��OH-����c��H+�� |
| B��AgCl������ת����AgI������Ksp��AgX��=c��Ag+��?c��X-������Ksp��AgI����K��AgCl�� |
| C��F��Cl��Br��I�ķǽ�����������HF��HCl��HBr��HIˮ��Һ���������� |
| D��������Ԫ���γ����Ӻ���������8�����ȶ��ṹ |
����������MX���䱥����Һ��M+��X-�����ʵ���Ũ��֮����ڹ�ϵ��ʽKsp=c��M+��?c��X-�����ֽ�������AgCl�ֱ�������������У�AgCl���ܽ�������ǣ�������
| A��40 mL 0.03 mol?L-1HCl��Һ |
| B��20 mL 0.02 mol?L-1KCl��Һ |
| C��30 mL 0.02 mol?L-1CaCl2��Һ |
| D��50 mL 0.05 mol?L-1AgNO3��Һ |
�ڲⶨ�к��ȵ�ʵ���У�ʹ��������Ʒ����Ϊ�˼�Сʵ�������ǣ�������
| A������ĭ���� | B�����β����� |
| C��Ӳֽ�� | D��������Ͳ |
 �������ԭ�����ش��������⣺
�������ԭ�����ش��������⣺