题目内容
某同学从资料上查到以下反应:
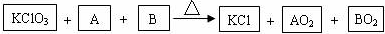
A、B为中学化学常见单质,AO2、BO2是能使澄清石灰水变浑浊的气体.
回答下列问题:
(1)①元素A、B可形成化合物AB2,则B元素的原子结构示意图为 .
②已知:A(s)+O2(g)=AO2(g)△H=-393.5kJ?mol-1
B(s)+O2(g)=BO2(g)△H=-296.8kJ?mol-1
A(s)+2B(s)=AB2(l)△H=+89.7kJ?mol-1
写出AB2(l)在O2中完全燃烧的热化学方程式 .
③黄色气体ClO2可用于污水杀菌和饮用水净化.KClO3与BO2在强酸性溶液中反应可制得ClO2,写出此反应的离子方程式 .
(2)恒容密闭容器中充有10mol AO与20mol H2,在催化剂作用下反应生成:AO(g)+2H2(g)?AH3OH(g);AO的平衡转化率(α)与温度、压强的关系如图.
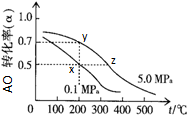
①若在x点时容器的体积为VxL,则该温度下的平衡常数K= ;
②自反应开始到达平衡状态所需的时间:tx tz(填“大于”、“小于”或“等于”).
③在不改变反应物用量的情况下,为提高AO的转化率可采取的措施是(写两条) .
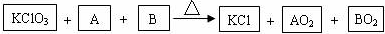
A、B为中学化学常见单质,AO2、BO2是能使澄清石灰水变浑浊的气体.
回答下列问题:
(1)①元素A、B可形成化合物AB2,则B元素的原子结构示意图为
②已知:A(s)+O2(g)=AO2(g)△H=-393.5kJ?mol-1
B(s)+O2(g)=BO2(g)△H=-296.8kJ?mol-1
A(s)+2B(s)=AB2(l)△H=+89.7kJ?mol-1
写出AB2(l)在O2中完全燃烧的热化学方程式
③黄色气体ClO2可用于污水杀菌和饮用水净化.KClO3与BO2在强酸性溶液中反应可制得ClO2,写出此反应的离子方程式
(2)恒容密闭容器中充有10mol AO与20mol H2,在催化剂作用下反应生成:AO(g)+2H2(g)?AH3OH(g);AO的平衡转化率(α)与温度、压强的关系如图.

①若在x点时容器的体积为VxL,则该温度下的平衡常数K=
②自反应开始到达平衡状态所需的时间:tx
③在不改变反应物用量的情况下,为提高AO的转化率可采取的措施是(写两条)
考点:用盖斯定律进行有关反应热的计算,转化率随温度、压强的变化曲线
专题:基本概念与基本理论
分析:(1)①A、B为中学化学常见单质,AO2、BO2是能使澄清石灰水变浑浊的气体,BO2能使品红溶液褪色,可以推断BO2为SO2,AO2为CO2;确定A为C,B为S;
②根据热化学方程式的书写方法以及盖斯定律来计算回答;
③根据题意所给反应物和产物的信息来书写离子方程式;
(2))①x、y点是同温度下的平衡,转化率变化,但平衡常数不变,根据x点温度下的转化率求平衡时各种物质的浓度,依据平衡常数概念计算得到;
②z点温度高反应速率快达到反应速率需要的时间短;
③提高CO的转化率可采取的措施是改变条件促使平衡正向进行.
②根据热化学方程式的书写方法以及盖斯定律来计算回答;
③根据题意所给反应物和产物的信息来书写离子方程式;
(2))①x、y点是同温度下的平衡,转化率变化,但平衡常数不变,根据x点温度下的转化率求平衡时各种物质的浓度,依据平衡常数概念计算得到;
②z点温度高反应速率快达到反应速率需要的时间短;
③提高CO的转化率可采取的措施是改变条件促使平衡正向进行.
解答:
解:A、B是中学化学常见单质,AO2、BO2是能使澄清石灰水变浑浊的气体,BO2能使品红溶液褪色,可以推断BO2为SO2,AO2为CO2;确定A为C,B为S;
(1)①B元素为S元素,原子结构示意图为 ,故答案为:
,故答案为: ;
;
②a、S(s)+O2(g)═SO2(g),△H=-393.5kJ?mol-1
b、S(s)+O2(g)═SO2(g),△H=-296.8kJ?mol-1
c、C(s)+2S(s)═CS2(l),△H=+89.7kJ?mol-1
二硫化碳燃烧的反应CS2(l)+3O2(g)═2SO2(g)+CO2(g),△H=a+2b-c,所以△H=(-393.5kJ?mol-1)+2×(-296.8kJ?mol-1)-89.7kJ?mol-1=-1076.8kJ?mol-1,
故答案为:CS2(l)+3O2(g)═2SO2(g)+CO2(g),△H=-1076.8kJ?mol-1;
③KClO3与SO2在强酸性溶液中反应制得ClO2的离子方程式为:2ClO3-+SO2═2ClO2+SO42-,故答案为:2ClO3-+SO2═2ClO2+SO42-;
(2))①依据图象分析可知xy是同温度下的平衡,平衡常数随温度变化,所以平衡常数不变;
CO(g)+2H2(g)?CH3OH(g)
初起浓度
mol/L
mol/L 0
变化量
mol/L
mol/L
mol/L
平衡量
mol/L
mol/L
mol/L
故K=
L2?mol-2=
L2?mol-2;
故答案为:
L2?mol-2;
②达到x、y两点的平衡状态所需的时间,y点温度高反应速率快达到反应速率需要的时间短,tx>ty,故答案为:大于;
③反应是气体体积减小的放热反应,提高CO的转化率可采取的措施是降温、加压、分离出甲醇,故答案为:降温、加压、将甲醇从混合体系中分离出来.
(1)①B元素为S元素,原子结构示意图为
 ,故答案为:
,故答案为: ;
;②a、S(s)+O2(g)═SO2(g),△H=-393.5kJ?mol-1
b、S(s)+O2(g)═SO2(g),△H=-296.8kJ?mol-1
c、C(s)+2S(s)═CS2(l),△H=+89.7kJ?mol-1
二硫化碳燃烧的反应CS2(l)+3O2(g)═2SO2(g)+CO2(g),△H=a+2b-c,所以△H=(-393.5kJ?mol-1)+2×(-296.8kJ?mol-1)-89.7kJ?mol-1=-1076.8kJ?mol-1,
故答案为:CS2(l)+3O2(g)═2SO2(g)+CO2(g),△H=-1076.8kJ?mol-1;
③KClO3与SO2在强酸性溶液中反应制得ClO2的离子方程式为:2ClO3-+SO2═2ClO2+SO42-,故答案为:2ClO3-+SO2═2ClO2+SO42-;
(2))①依据图象分析可知xy是同温度下的平衡,平衡常数随温度变化,所以平衡常数不变;
CO(g)+2H2(g)?CH3OH(g)
初起浓度
| 10 |
| Vx |
| 20 |
| Vx |
变化量
| 5 |
| Vx |
| 10 |
| Vx |
| 5 |
| Vx |
平衡量
| 5 |
| Vx |
| 10 |
| Vx |
| 5 |
| Vx |
故K=
| ||||
|
| ||
| 100 |
故答案为:
| ||
| 100 |
②达到x、y两点的平衡状态所需的时间,y点温度高反应速率快达到反应速率需要的时间短,tx>ty,故答案为:大于;
③反应是气体体积减小的放热反应,提高CO的转化率可采取的措施是降温、加压、分离出甲醇,故答案为:降温、加压、将甲醇从混合体系中分离出来.
点评:本题考查了热化学方程式和盖斯定律的计算应用,化学平衡标志判断,图象分析,影响平衡的因素分析判断,化学平衡移动原理是解题关键,题目难度中等.

练习册系列答案
相关题目
agO2中含b个氧原子,则阿伏加德罗常数的值可表示为( )
| A、2b | ||
B、
| ||
C、
| ||
| D、b |
下列说法不正确的是 ( )
| A、用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| B、物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的 |
| C、对于Al(OH)3(s)?Al(OH)3(aq)?Al3++3OH-,前者为溶解平衡,后者为电离平衡 |
| D、除溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大 |
| E、沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全 |
下列说法正确的是( )
| A、溶度积就是溶解平衡时难溶电解质在溶液中的各离子浓度的乘积 |
| B、溶度积常数是不受任何条件影响的常数,简称溶度积 |
| C、可用离子积Qc判断沉淀溶解平衡进行的方向 |
| D、所有物质的溶度积都是随温度的升高而增大的 |
 大气中的部分碘源于O3对海水中I-的氧化.将O3持续通入NaI酸性溶液溶液中进行模拟研究.
大气中的部分碘源于O3对海水中I-的氧化.将O3持续通入NaI酸性溶液溶液中进行模拟研究.
 某校化学兴趣小组的同学用如图装置进行实验,已知分液漏斗、小试管中均盛有水.请回答下列问题:
某校化学兴趣小组的同学用如图装置进行实验,已知分液漏斗、小试管中均盛有水.请回答下列问题: 运用相关原理,回答下列问题:
运用相关原理,回答下列问题: