题目内容
 (1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
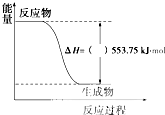
(1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:①如图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“-”.
②写出表示丙烷燃烧的热化学方程式:
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔.1mol 二甲醚完全燃烧生成CO2和液态水放出1 455kJ热量.若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为
(2)碳(s)在氧气供应不足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+
| 1 |
| 2 |
考点:有关反应热的计算
专题:
分析:(1)①分析图象得到生成1mol水的焓变△H=-553.75KJ/mol;
②依据热化学方程式书写方法写出,注意物质聚集状态,对应量下的焓变;
③依据热化学方程式结合混合气体物质的量和放热列式计算得到二甲醚和丙烷物质的量之比;
(2)设计实验、利用盖斯定律计算C(s)+
O2(g)═CO(g)的△H,需要知道碳和一氧化碳的燃烧热才能计算得到.
②依据热化学方程式书写方法写出,注意物质聚集状态,对应量下的焓变;
③依据热化学方程式结合混合气体物质的量和放热列式计算得到二甲醚和丙烷物质的量之比;
(2)设计实验、利用盖斯定律计算C(s)+
| 1 |
| 2 |
解答:
解:(1)①图象是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,丙烷燃烧反应放热△H=-553.75KJ/mol,故答案为:-;
②丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,反应放热△H=-553.75KJ/mol;则写出的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H1=-2215.0 kJ/mol,故答案为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H1=-2215.0 kJ/mol;
③1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量.若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,
设1mol混合气体中二甲醚物质的量x,丙烷物质的量为1-x,C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H1=-2215.0 kJ/mol,得到丙烷燃烧放热(1-x)2215KJ;依据条件得到:1645KJ-1455xKJ=(1-x)2215KJ,计算得到x=0.75,则混合丙烷物质的量为0.25mol,则混合气体中丙烷和二甲醚物质的量之比=0.25:0.75=1:3;
故答案为:1:3;
(2)设计实验、利用盖斯定律计算C(s)+
O2(g)═CO(g)的△H,需要知道碳和一氧化碳的燃烧热才能计算得到,故答案为:碳、一氧化碳的标准燃烧热.
②丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,反应放热△H=-553.75KJ/mol;则写出的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H1=-2215.0 kJ/mol,故答案为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H1=-2215.0 kJ/mol;
③1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量.若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,
设1mol混合气体中二甲醚物质的量x,丙烷物质的量为1-x,C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H1=-2215.0 kJ/mol,得到丙烷燃烧放热(1-x)2215KJ;依据条件得到:1645KJ-1455xKJ=(1-x)2215KJ,计算得到x=0.75,则混合丙烷物质的量为0.25mol,则混合气体中丙烷和二甲醚物质的量之比=0.25:0.75=1:3;
故答案为:1:3;
(2)设计实验、利用盖斯定律计算C(s)+
| 1 |
| 2 |
点评:本题考查了热化学方程式的书写方法,盖斯定律的计算应用,掌握热化学方程式的意义和盖斯定律的应用是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:①5mL水 ②20mL 0.5mol?L-1的Na2SO4溶液 ③40mL 0.2mol?L-1的Ba(OH)2溶液 ④40mL 0.1mol?L-1的H2SO4溶液中,溶解至饱和.以上各溶液中,c(Ba2+)的大小顺序正确的是( )
| A、③>①>④>② |
| B、③>①>②>④ |
| C、①>④>③>② |
| D、①>③>④>② |
在一定条件下,将3molSO2、2molO2、4molSO3的气体混合物充入一体积为2L的密闭容器中充分反应,10min后反应达到平衡.已知这段时间内v(SO2)=0.02mol/(L?min),则这段时间内SO3的物质的量浓度可能为( )
| A、6mol/L |
| B、3mol/L |
| C、2mol/L |
| D、1mol/L |
有关AgCl的沉淀溶解平衡的说法中,不正确的是( )
| A、在盐酸溶液中,AgCl的溶解度会减小 |
| B、向存在AgCl沉淀的少量溶液中加入NaI固体,会生成黄色沉淀 |
| C、向AgNO3溶液中加入足量盐酸,反应后的溶液中没有Ag+ |
| D、达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不断进行,但速率相等 |
 大气中的部分碘源于O3对海水中I-的氧化.将O3持续通入NaI酸性溶液溶液中进行模拟研究.
大气中的部分碘源于O3对海水中I-的氧化.将O3持续通入NaI酸性溶液溶液中进行模拟研究.
 已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g)
已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g) 如图把混合气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
如图把混合气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( ) 运用相关原理,回答下列问题:
运用相关原理,回答下列问题: