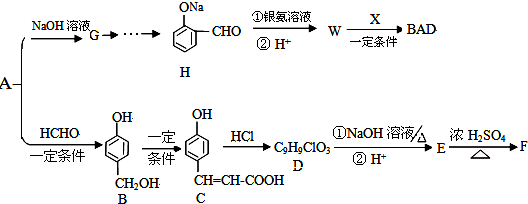
题目内容
某NaOH固体因密封不严而部分变质为Na2CO3.为测定其成份含量,称取0.700g(其它杂质不与HCl反应)烧碱固体稀释至100mL,然后作如下测定:
①取稀释液20.0mL滴入2~3滴甲基橙作指示剂,用0.110mol/L的盐酸滴定,达终点时消耗盐酸26.0mL;
②另取稀释液20.0mL,加入过量的BaCl2溶液,过滤,在滤液中滴入2~3滴酚酞作指示剂,用上述盐酸滴定,达终点时时消耗盐酸20.0mL.
请回答:
(1)操作①达终点时颜色变化是 .
(2)第②步操作如果不过滤,在有沉淀的溶液中直接用盐酸滴定,当滴定到终点时,溶液中的BaCO3变为了(写化学式) ,原因是 .
(3)请计算该烧碱样品中NaOH和Na2CO3的质量分数.
①取稀释液20.0mL滴入2~3滴甲基橙作指示剂,用0.110mol/L的盐酸滴定,达终点时消耗盐酸26.0mL;
②另取稀释液20.0mL,加入过量的BaCl2溶液,过滤,在滤液中滴入2~3滴酚酞作指示剂,用上述盐酸滴定,达终点时时消耗盐酸20.0mL.
请回答:
(1)操作①达终点时颜色变化是
(2)第②步操作如果不过滤,在有沉淀的溶液中直接用盐酸滴定,当滴定到终点时,溶液中的BaCO3变为了(写化学式)
(3)请计算该烧碱样品中NaOH和Na2CO3的质量分数.
考点:中和滴定,探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)用甲基橙作指示剂时,滴定前,甲基橙遇碱变黄,滴定后若变橙色,停止滴定;
(2)用酚酞作指示剂,达到滴定终点时溶液显弱碱性,此时溶液中发生的反应为盐酸与Na2CO3和BaCO3反应生成碳酸的酸式盐;因为碳酸氢钠稀溶液的pH恰好是酚酞的变色范围;
(3)取稀释液20.0mL,加入过量的BaCl2溶液,过滤,在滤液中滴入2~3滴酚酞作指示剂,用上述盐酸滴定,达终点时时消耗盐酸20.0mL,滴定时盐酸与氢氧化钠反应,根据盐酸的物质的量求出氢氧化钠的物质的量和质量,再求出氢氧化钠的质量分数;
取稀释液20.0mL滴入2~3滴甲基橙作指示剂,用0.110mol/L的盐酸滴定,达终点时消耗盐酸26.0mL,滴定时盐酸与氢氧化钠反应,还与碳酸钠反应生成二氧化碳,盐酸的总体积减去与氢氧化钠反应的体积即是与碳酸钠反应消耗的体积,根据盐酸与碳酸钠反应的量的关系求出碳酸钠的物质的量和质量,再求出质量分数.
(2)用酚酞作指示剂,达到滴定终点时溶液显弱碱性,此时溶液中发生的反应为盐酸与Na2CO3和BaCO3反应生成碳酸的酸式盐;因为碳酸氢钠稀溶液的pH恰好是酚酞的变色范围;
(3)取稀释液20.0mL,加入过量的BaCl2溶液,过滤,在滤液中滴入2~3滴酚酞作指示剂,用上述盐酸滴定,达终点时时消耗盐酸20.0mL,滴定时盐酸与氢氧化钠反应,根据盐酸的物质的量求出氢氧化钠的物质的量和质量,再求出氢氧化钠的质量分数;
取稀释液20.0mL滴入2~3滴甲基橙作指示剂,用0.110mol/L的盐酸滴定,达终点时消耗盐酸26.0mL,滴定时盐酸与氢氧化钠反应,还与碳酸钠反应生成二氧化碳,盐酸的总体积减去与氢氧化钠反应的体积即是与碳酸钠反应消耗的体积,根据盐酸与碳酸钠反应的量的关系求出碳酸钠的物质的量和质量,再求出质量分数.
解答:
解:(1)用甲基橙作指示剂时,滴定前,甲基橙遇碱变黄,到达滴定终点时观察到溶液颜色由黄色变为橙色;
故答案为:溶液由黄色变为橙色;
(2)用酚酞作指示剂,酚酞变色的pH范围是8-10,盐酸与碳酸钠反应生成的碳酸氢钠稀溶液的pH恰好是酚酞的变色范围,此时溶液中发生的反应为:盐酸与Na2CO3生成氯化钠和碳酸氢钠,盐酸与BaCO3反应生成氯化钡和碳酸氢钡;
故答案为:BaCl2、Ba(HCO3)2;NaHCO3水解后的稀溶液pH值范围,恰好是酚酞的变色范围;
(3)取稀释液20.0mL,加入过量的BaCl2溶液,过滤,在滤液中滴入2~3滴酚酞作指示剂,用上述盐酸滴定,达终点时时消耗盐酸20.0mL,滴定时盐酸与氢氧化钠反应,n(NaOH)=n(HCl)=cV=0.02L×0.110mol/L=0.0022mol,
则m(NaOH)=nM=0.0022mol×40g/mol=0.088g,则原溶液中氢氧化钠的质量为m(NaOH)=0.088g×
=0.440g,
氢氧化钠的质量分数为
×100%=62.9%;
取稀释液20.0mL滴入2~3滴甲基橙作指示剂,用0.110mol/L的盐酸滴定,达终点时消耗盐酸26.0mL,滴定时盐酸与氢氧化钠反应,还与碳酸钠反应生成二氧化碳,则与碳酸钠反应消耗的体积为26mL-20mL=6mL,则n(Na2CO3)=
n(HCl)=
×0.006L×0.110mol/L=0.00033mol,
则m(Na2CO3)=0.00033mol×106g/mol×
=0.1749g,
Na2CO3的质量分数是
×100%=25.0%;
答:该烧碱NaOH质量分数是62.9%,Na2CO3的质量分数是25.0%.
故答案为:溶液由黄色变为橙色;
(2)用酚酞作指示剂,酚酞变色的pH范围是8-10,盐酸与碳酸钠反应生成的碳酸氢钠稀溶液的pH恰好是酚酞的变色范围,此时溶液中发生的反应为:盐酸与Na2CO3生成氯化钠和碳酸氢钠,盐酸与BaCO3反应生成氯化钡和碳酸氢钡;
故答案为:BaCl2、Ba(HCO3)2;NaHCO3水解后的稀溶液pH值范围,恰好是酚酞的变色范围;
(3)取稀释液20.0mL,加入过量的BaCl2溶液,过滤,在滤液中滴入2~3滴酚酞作指示剂,用上述盐酸滴定,达终点时时消耗盐酸20.0mL,滴定时盐酸与氢氧化钠反应,n(NaOH)=n(HCl)=cV=0.02L×0.110mol/L=0.0022mol,
则m(NaOH)=nM=0.0022mol×40g/mol=0.088g,则原溶液中氢氧化钠的质量为m(NaOH)=0.088g×
| 100mL |
| 20mL |
氢氧化钠的质量分数为
| 0.440g |
| 0.700 |
取稀释液20.0mL滴入2~3滴甲基橙作指示剂,用0.110mol/L的盐酸滴定,达终点时消耗盐酸26.0mL,滴定时盐酸与氢氧化钠反应,还与碳酸钠反应生成二氧化碳,则与碳酸钠反应消耗的体积为26mL-20mL=6mL,则n(Na2CO3)=
| 1 |
| 2 |
| 1 |
| 2 |
则m(Na2CO3)=0.00033mol×106g/mol×
| 100mL |
| 20mL |
Na2CO3的质量分数是
| 0.1749g |
| 0.700g |
答:该烧碱NaOH质量分数是62.9%,Na2CO3的质量分数是25.0%.
点评:本题考查中和滴定操作、物质组成和含量的测定,题目难度中等,侧重于考查学生的实验能力和数据处理能力,注意把握溶液中发生的反应.

练习册系列答案
相关题目
 实验室里有一瓶试剂的标签部分被腐蚀,如图所示,仅知该试剂是只含短周期元素的纯净物.某同学设计实验探究该试剂成分,实验现象和结论都正确的是( )
实验室里有一瓶试剂的标签部分被腐蚀,如图所示,仅知该试剂是只含短周期元素的纯净物.某同学设计实验探究该试剂成分,实验现象和结论都正确的是( )| A、取该样品加入足量的硝酸钡溶液和稀盐酸,产生白色沉淀,则该样品的成分一定是硫酸钠 |
| B、取该样品溶于水,测得溶液pH=10,将溶液放置在空气中,一段时间后再测定溶液pH=7,该样品可能是亚硫酸钠 |
| C、取该样品溶于水,加入足量稀硫酸,将产生气体通入品红溶液,品红溶液褪色,加热溶液变红色,则样品成分是Na2S |
| D、若样品成分是硅酸钠(Na2SiO3),溶于水,滴加盐酸至过量,先生成白色沉淀,后沉淀溶解 |
 某同学设计了如下方案,来测定过氧化钠的样品的纯度(杂质不参加反应,条件为标准状况).
某同学设计了如下方案,来测定过氧化钠的样品的纯度(杂质不参加反应,条件为标准状况).
 )
)

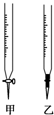 温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: