题目内容
 某同学设计了如下方案,来测定过氧化钠的样品的纯度(杂质不参加反应,条件为标准状况).
某同学设计了如下方案,来测定过氧化钠的样品的纯度(杂质不参加反应,条件为标准状况).实验原理:2Na2O2+2H2O=4NaOH+O2↑
通过测定生成的氧气的体积,经计算可确定样品过氧化钠的质量.
实验步骤:
①称取过氧化钠固体2.00g;
②把这些过氧化钠放入气密性良好的气体发生装置中;
③向过氧化钠中滴入水,用量筒排水集气,量筒内液
面在110mL处恰与水槽内液面相平;
④作为反应器的烧瓶中有54.0mL液体;
⑤将烧瓶内的液体转移到250mL的容量瓶内,并加水定容.
请回答下列问题:
(1)有1 000mL、500mL、250mL的量筒备用,则应选用
(2)生成气体体积是
(3)据研究,与上述反应同时发生的反应还有:Na2O2+2H2O=2NaOH+H2O2,H2O2的生成会使测定结果
(4)为校正实验结果,该学生补做了如下实验:用移液管移取20.00mL容量瓶中的液体,放入锥形瓶中,用0.0100mol/L的KMnO4溶液去测定,至溶液中刚好出现浅浅的紫红色,停止滴定,用去了24.00mLKMnO4溶液.反应式:2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O,该实验应选用
(5)通过以上数据计算,该过氧化钠的纯度为
(6)如何避免因为生成H2O2造成的误差?
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)根据测量的体积选择,选择尽可能接近最大量程的量筒;
(2)根据生成气体体积=用量气装置测得气体体积-锥形瓶中液体体积;根据量气装置测得气体体积的要求;
(3)根据产生的气体偏少;因促使H2O2分解;
(4)酸高锰酸钾溶液具有强氧化性,腐蚀橡皮管;
(5)先根据气体的体积利用化学方程式2Na2O2+2H2O═4NaOH+O2计算出Na2O2的物质的量,再根据化学方程式2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2+8H2O计算出产生的H2O2,利用反应Na2O2+2H2O═2NaOH+H202计算出生成H202的Na2O2,最后求出n(Na2O2总),从而求出质量分数;
(6)根据过氧化氢的性质分析,加催化剂使其分解.
(2)根据生成气体体积=用量气装置测得气体体积-锥形瓶中液体体积;根据量气装置测得气体体积的要求;
(3)根据产生的气体偏少;因促使H2O2分解;
(4)酸高锰酸钾溶液具有强氧化性,腐蚀橡皮管;
(5)先根据气体的体积利用化学方程式2Na2O2+2H2O═4NaOH+O2计算出Na2O2的物质的量,再根据化学方程式2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2+8H2O计算出产生的H2O2,利用反应Na2O2+2H2O═2NaOH+H202计算出生成H202的Na2O2,最后求出n(Na2O2总),从而求出质量分数;
(6)根据过氧化氢的性质分析,加催化剂使其分解.
解答:
解:(1)若2g为纯净Na2O2,设能生成VL气体
2Na2O2+2H2O=4NaOH+O2↑
2×78g/L 22.4L/mol
2g V
则V=
=0.287L=287ml
那么2gNa2O2最多可以生成的O2体积为287ml
所以应该选用大于287ml的最小的量筒,也就是500ml的量筒,
故答案为:500;2gNa2O2反应生成的O2体积为287ml,所测量体积尽可能接近仪器的最大量程;
(2)滴入烧瓶的液体会把原来装置中的空气排入量气装置中,进入量气装置的空气的体积等于进入烧瓶的液体的体积,所以量气装置中O2的体积=用量气装置测得气体体积-锥形瓶中液体体积,所以生成气体体积为110-54=56mL;为保证测定气体体积的准确性,读取量筒刻度时要移动量筒,使量筒内外液面持平;
故答案为:56;使量筒内外液面持平;
(3)同时发生的反应还有:Na2O2+2H2O=2NaOH+H2O2,因产生的气体偏少,计算出的Na2O2也偏少,所以会使测定结果偏低,
故答案为:偏低;
(4)酸高锰酸钾溶液具有强氧化性,腐蚀碱式滴定管中的橡皮管,所以用酸式滴定管,
故答案为:酸式滴定管;
(5)生成O2为56mL,则n(O2)=
=0.0025mol,
2Na2O2+2H2O═4NaOH+O2
2 l
nl(Na2O2) 0.0025mol
则n1(Na2O2)=0.005mol,
2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2+8H2O,Na2O2+2H2O═2NaOH+H2O2
得关系式:2KmnO4~~~~~~~5H2O2 ~~~~~5Na2O2
2 5
0.02400L×0.010mol/L×
n2(Na2O2)
解得:n2(Na2O2)=0.02400L×0.010mol/L×
×
=0.0075mol
n(Na2O2总)=0.0075mol+0.005mol=0.0125mol
Na2O2%(纯度)=
×100%=48.75%;
答:过氧化钠的纯度为48.75%;
(6)因为反应生成H2O2使生成的氧气偏少,加二氧化锰能促使H2O2分解生成氧气,才能减少误差,所以事先在锥形瓶中加一些MnO2使H2O2分解,
故答案为:在过氧化钠与水反应之前加少量的二氧化锰.
2Na2O2+2H2O=4NaOH+O2↑
2×78g/L 22.4L/mol
2g V
则V=
| 22.4L/mol×2g |
| 2×78g/mol |
那么2gNa2O2最多可以生成的O2体积为287ml
所以应该选用大于287ml的最小的量筒,也就是500ml的量筒,
故答案为:500;2gNa2O2反应生成的O2体积为287ml,所测量体积尽可能接近仪器的最大量程;
(2)滴入烧瓶的液体会把原来装置中的空气排入量气装置中,进入量气装置的空气的体积等于进入烧瓶的液体的体积,所以量气装置中O2的体积=用量气装置测得气体体积-锥形瓶中液体体积,所以生成气体体积为110-54=56mL;为保证测定气体体积的准确性,读取量筒刻度时要移动量筒,使量筒内外液面持平;
故答案为:56;使量筒内外液面持平;
(3)同时发生的反应还有:Na2O2+2H2O=2NaOH+H2O2,因产生的气体偏少,计算出的Na2O2也偏少,所以会使测定结果偏低,
故答案为:偏低;
(4)酸高锰酸钾溶液具有强氧化性,腐蚀碱式滴定管中的橡皮管,所以用酸式滴定管,
故答案为:酸式滴定管;
(5)生成O2为56mL,则n(O2)=
| 0.056L |
| 22.4L/mol |
2Na2O2+2H2O═4NaOH+O2
2 l
nl(Na2O2) 0.0025mol
则n1(Na2O2)=0.005mol,
2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2+8H2O,Na2O2+2H2O═2NaOH+H2O2
得关系式:2KmnO4~~~~~~~5H2O2 ~~~~~5Na2O2
2 5
0.02400L×0.010mol/L×
| 250ml |
| 20ml |
解得:n2(Na2O2)=0.02400L×0.010mol/L×
| 250ml |
| 20ml |
| 5 |
| 2 |
n(Na2O2总)=0.0075mol+0.005mol=0.0125mol
Na2O2%(纯度)=
| 0.0125mol×78g/mol |
| 2g |
答:过氧化钠的纯度为48.75%;
(6)因为反应生成H2O2使生成的氧气偏少,加二氧化锰能促使H2O2分解生成氧气,才能减少误差,所以事先在锥形瓶中加一些MnO2使H2O2分解,
故答案为:在过氧化钠与水反应之前加少量的二氧化锰.
点评:本题考查了物质含量的测定,结合实验考查了过氧化钠与水反应的性质,题目难度中等,侧重于考查学生分析问题、解决问题的能力、实验探究能力和数据处理能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
| A、NaCl的摩尔质量是58.5 g/mol |
| B、18 g H2O中所含水分子的物质的量是0.5 mol |
| C、22 g CO2中所含分子数约为6.02×1023 |
| D、任何条件下,22.4 L氢气中所含氢原子数都约为1.204×1024 |
熔融烧碱应选用的器皿是( )
| A、铁制坩埚 | B、普通玻璃坩埚 |
| C、石英坩埚 | D、陶瓷坩埚 |
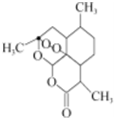 被誉为中国“新四大发明”之一的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.其主要成分是青蒿素(一种从青蒿中分离得到的具有新型化学结构的抗疟药),其结构简式如下图所示.下列有关该有机物的叙述正确的是( )
被誉为中国“新四大发明”之一的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.其主要成分是青蒿素(一种从青蒿中分离得到的具有新型化学结构的抗疟药),其结构简式如下图所示.下列有关该有机物的叙述正确的是( )| A、该有机物的分子式为C14H23O5 |
| B、该有机物不能与NaOH溶液反应 |
| C、该有机物分子中含有过氧键,一定条件下具有氧化性 |
| D、该有机物易溶于水 |