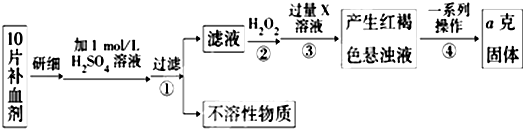
题目内容
我国规定:室内甲醛含量不得超过0.08mg?m-3.某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛(HCHO)的含量.
【查阅资料】KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸.
4MnO4-+5HCHO+H+═4Mn2++5CO2↑+11H2O; 2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O
【实验一】按如图所示装置进行采样

(1)由图可知甲醛的物理性质为 .
(2)空气中甲醛采样吸收装置中用到的玻璃仪器为:玻璃导管、 .
(3)为了使通过吸收装置的甲醛尽可能被吸收液吸收,可采取的措施是: (只写出一种即可)
设置空气采集器为恒定流量0.5L/min,采集20min.
【实验二】
量取10.00mL的甲醛吸收液转移到锥形瓶中,量取12.00mL1.00×10-3mol?L-1KMnO4溶液于锥形瓶中,并滴入几滴稀H2SO4备用.
(4)用1.00×10-3mol?L-1标准草酸溶液进行滴定,当 时,达到滴定终点.
(5)记录滴定所消耗的草酸溶液的体积,重复实验2次,消耗草酸溶液体积分别为10.90mL、10.02mL、9.98mL.计算该居室内空气中甲醛的浓度为 mg?m-3.
(6)若滴定过程中,发现滴定管下端开始有气泡,滴定后气泡消失,则测定结果将
(填“偏大”、“无影响”、“偏小”).
【实验三】
环境监测站工作人员采样后,将5.00mL的甲醛吸收液注入比色瓶中,再向比色瓶中注入显色
试剂0.5mL,盖紧瓶塞,摇匀,静置显色.当室内环境温度不同时,记录显色时间见下表.
(7)由该表可以得出的结论是 .
(8)请用化学反应原理解释 .
【查阅资料】KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸.
4MnO4-+5HCHO+H+═4Mn2++5CO2↑+11H2O; 2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O
【实验一】按如图所示装置进行采样

(1)由图可知甲醛的物理性质为
(2)空气中甲醛采样吸收装置中用到的玻璃仪器为:玻璃导管、
(3)为了使通过吸收装置的甲醛尽可能被吸收液吸收,可采取的措施是:
设置空气采集器为恒定流量0.5L/min,采集20min.
【实验二】
量取10.00mL的甲醛吸收液转移到锥形瓶中,量取12.00mL1.00×10-3mol?L-1KMnO4溶液于锥形瓶中,并滴入几滴稀H2SO4备用.
(4)用1.00×10-3mol?L-1标准草酸溶液进行滴定,当
(5)记录滴定所消耗的草酸溶液的体积,重复实验2次,消耗草酸溶液体积分别为10.90mL、10.02mL、9.98mL.计算该居室内空气中甲醛的浓度为
(6)若滴定过程中,发现滴定管下端开始有气泡,滴定后气泡消失,则测定结果将
(填“偏大”、“无影响”、“偏小”).
【实验三】
环境监测站工作人员采样后,将5.00mL的甲醛吸收液注入比色瓶中,再向比色瓶中注入显色
试剂0.5mL,盖紧瓶塞,摇匀,静置显色.当室内环境温度不同时,记录显色时间见下表.
| 环境温度/°C | 5 | 10 | 15 | 20 | 25 | 30 | 35 |
| 显色时间/min | 45 | 30 | 15 | 13 | 10 | 7 | 5 |
(8)请用化学反应原理解释
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)装置图表示,甲醛为气体,易溶于水;
(2)空气中甲醛采样吸收装置中用到的玻璃仪器为广口瓶;
(3)为了使通过吸收装置的甲醛尽可能被吸收液吸收,可以增大吸收面积,减慢采集速率;
(4)量取10.00mL的甲醛吸收液转移到锥形瓶中,量取12.00mL1.00×10-3mol?L-1KMnO4溶液于锥形瓶中,并滴入几滴稀H2SO4,发生氧化还原反应,过量的高锰酸钾溶液用1.00×10-3mol?L-1标准草酸溶液进行滴定,滴入最后一滴溶液紫红色变化为无色且半分钟内不发生变化;
(5)依据反应的定量关系分析计算,测定过程中草酸体积10.90mL误差较大舍去,利用两次的平均值计算消耗的体积,计算得到消耗高锰酸钾物质的量,高锰酸钾总物质的量-草酸消耗物质的量=与甲醛反应的高锰酸钾物质的量,计算甲醛浓度;
(6)滴定管下端开始有气泡,滴定后气泡消失,读取草酸溶液体积增大,消耗高锰酸钾量增大,与甲醛反应的高锰酸钾减小;
(7)分析图表数据随温度升高,显色时间缩短,是因为升温反应速率增大;
(8)依据影响化学反应速率因素分析判断;
(2)空气中甲醛采样吸收装置中用到的玻璃仪器为广口瓶;
(3)为了使通过吸收装置的甲醛尽可能被吸收液吸收,可以增大吸收面积,减慢采集速率;
(4)量取10.00mL的甲醛吸收液转移到锥形瓶中,量取12.00mL1.00×10-3mol?L-1KMnO4溶液于锥形瓶中,并滴入几滴稀H2SO4,发生氧化还原反应,过量的高锰酸钾溶液用1.00×10-3mol?L-1标准草酸溶液进行滴定,滴入最后一滴溶液紫红色变化为无色且半分钟内不发生变化;
(5)依据反应的定量关系分析计算,测定过程中草酸体积10.90mL误差较大舍去,利用两次的平均值计算消耗的体积,计算得到消耗高锰酸钾物质的量,高锰酸钾总物质的量-草酸消耗物质的量=与甲醛反应的高锰酸钾物质的量,计算甲醛浓度;
(6)滴定管下端开始有气泡,滴定后气泡消失,读取草酸溶液体积增大,消耗高锰酸钾量增大,与甲醛反应的高锰酸钾减小;
(7)分析图表数据随温度升高,显色时间缩短,是因为升温反应速率增大;
(8)依据影响化学反应速率因素分析判断;
解答:
解:(1)装置图表示,常温下甲醛为气体,可以溶于水,故答案为:常温下是气体,可溶于水;
(2)空气中甲醛采样吸收装置中用到的玻璃仪器,应是气体通过能溶解甲醛属于洗气瓶装置,导气管长进短出,选择为广口瓶,需要玻璃仪器为玻璃导管、广口瓶;
故答案为:广口瓶;
(3)为了使通过吸收装置的甲醛尽可能被吸收液吸收,可以增大吸收面积,减慢采集速率,为了使通过吸收装置的甲醛尽可能被吸收液吸收,可采取的措施是,在洗气瓶长玻璃导管的下端接一个玻璃球泡;减慢空气采集器的流速;
故答案为:在洗气瓶长玻璃导管的下端接一个玻璃球泡;减慢空气采集器的流速;
(4)量取10.00mL的甲醛吸收液转移到锥形瓶中,量取12.00mL1.00×10-3mol?L-1KMnO4溶液于锥形瓶中,并滴入几滴稀H2SO4,发生氧化还原反应,过量的高锰酸钾溶液用1.00×10-3mol?L-1标准草酸溶液进行滴定,滴入最后一滴溶液紫红色变化为无色且半分钟内不发生变化,说明反应达到终点;
故答案为:滴加最后一滴草酸溶液时,溶液恰好由紫红色变为无色,且半分钟内不褪色;
(5)依据反应的定量关系分析计算,测定过程中草酸体积10.90mL误差较大舍去,利用两次的平均值计算消耗的体积=
=10ml,
2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O
2 5
n 0.010L×1.00×10-3mol?L-1
n=4×10-6mol
与甲醛反应的高锰酸钾物质的量=0.012L×1.00×10-3mol?L-1-4×10-6mol=8×10-6mol
4MnO4-+5HCHO+H+═4Mn2++5CO2↑+11H2O
4 5
8×10-6mol n(HCHO)
n(HCHO)=1×10-5mol,甲醛摩尔质量为30g/mol
计算得到甲醛浓度=300mg?m-3;
故答案为:300;
(6)滴定管下端开始有气泡,滴定后气泡消失,读取草酸溶液体积增大,消耗高锰酸钾量增大,与甲醛反应的高锰酸钾减小,测定结果偏低;
故答案为:偏小;
(7)分析图表数据随温度升高,显色时间缩短,是因为升温反应速率增大;
故答案为:温度越高,显色时间越短,化学反应速率越快;
(8)依据影响化学法因数控的因素分析可知,升高温度,能提高化学反应速率;
故答案为:升高温度,能提高化学反应速率.
(2)空气中甲醛采样吸收装置中用到的玻璃仪器,应是气体通过能溶解甲醛属于洗气瓶装置,导气管长进短出,选择为广口瓶,需要玻璃仪器为玻璃导管、广口瓶;
故答案为:广口瓶;
(3)为了使通过吸收装置的甲醛尽可能被吸收液吸收,可以增大吸收面积,减慢采集速率,为了使通过吸收装置的甲醛尽可能被吸收液吸收,可采取的措施是,在洗气瓶长玻璃导管的下端接一个玻璃球泡;减慢空气采集器的流速;
故答案为:在洗气瓶长玻璃导管的下端接一个玻璃球泡;减慢空气采集器的流速;
(4)量取10.00mL的甲醛吸收液转移到锥形瓶中,量取12.00mL1.00×10-3mol?L-1KMnO4溶液于锥形瓶中,并滴入几滴稀H2SO4,发生氧化还原反应,过量的高锰酸钾溶液用1.00×10-3mol?L-1标准草酸溶液进行滴定,滴入最后一滴溶液紫红色变化为无色且半分钟内不发生变化,说明反应达到终点;
故答案为:滴加最后一滴草酸溶液时,溶液恰好由紫红色变为无色,且半分钟内不褪色;
(5)依据反应的定量关系分析计算,测定过程中草酸体积10.90mL误差较大舍去,利用两次的平均值计算消耗的体积=
| 10.02ml+9.98ml |
| 2 |
2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O
2 5
n 0.010L×1.00×10-3mol?L-1
n=4×10-6mol
与甲醛反应的高锰酸钾物质的量=0.012L×1.00×10-3mol?L-1-4×10-6mol=8×10-6mol
4MnO4-+5HCHO+H+═4Mn2++5CO2↑+11H2O
4 5
8×10-6mol n(HCHO)
n(HCHO)=1×10-5mol,甲醛摩尔质量为30g/mol
计算得到甲醛浓度=300mg?m-3;
故答案为:300;
(6)滴定管下端开始有气泡,滴定后气泡消失,读取草酸溶液体积增大,消耗高锰酸钾量增大,与甲醛反应的高锰酸钾减小,测定结果偏低;
故答案为:偏小;
(7)分析图表数据随温度升高,显色时间缩短,是因为升温反应速率增大;
故答案为:温度越高,显色时间越短,化学反应速率越快;
(8)依据影响化学法因数控的因素分析可知,升高温度,能提高化学反应速率;
故答案为:升高温度,能提高化学反应速率.
点评:本题考查了物质组成的实验探究方法和实验过程分析判断,主要是实验基本操作和定量关系的计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
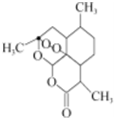 被誉为中国“新四大发明”之一的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.其主要成分是青蒿素(一种从青蒿中分离得到的具有新型化学结构的抗疟药),其结构简式如下图所示.下列有关该有机物的叙述正确的是( )
被誉为中国“新四大发明”之一的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.其主要成分是青蒿素(一种从青蒿中分离得到的具有新型化学结构的抗疟药),其结构简式如下图所示.下列有关该有机物的叙述正确的是( )| A、该有机物的分子式为C14H23O5 |
| B、该有机物不能与NaOH溶液反应 |
| C、该有机物分子中含有过氧键,一定条件下具有氧化性 |
| D、该有机物易溶于水 |
将1mol SO2和1mol O2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:2SO2(g)+O2(g)?2SO3(g).反应达到平衡时SO3为0.3mol.若此时移走0.5mol O2和0.5mol SO2,则重新达到平衡后,SO3的物质的量( )
| A、等于0.3 mol |
| B、等于0.15 mol |
| C、小于0.15 mol |
| D、大于0.15 mol,小于0.3 mol |
下列说法正确的是( )
| A、有氨水可以鉴别MgCl2溶液和AlCl3溶液 |
| B、可以用澄清的石灰水鉴别SO2和CO2 |
| C、SO2能使FeCl3、KMnO4水溶液褪色 |
| D、金属钠与CuSO4溶液反应能析出单质Cu |
下列各种醇既可发生消去反应,又可被氧化成相应醛的是( )
| A、CH3OH |
| B、HOCH2CH2CH3 |
| C、CH3CHOHCH3 |
| D、(CH3)3COH |
下列关于油脂的叙述不正确的是( )
| A、属于酯类 |
| B、没有固定的熔沸点 |
| C、是高级脂肪酸的甘油酯 |
| D、油脂的氢化属于氧化反应 |