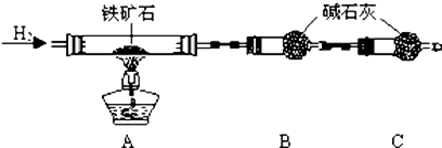
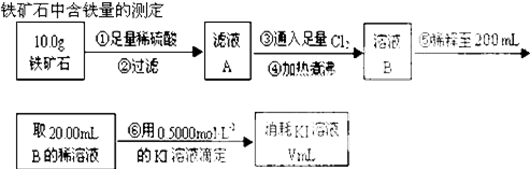
题目内容
3.明矾石的主要成分为K2SO4•Al2(SO4)3•2Al2O3•6H2O,此外还含有少量Fe2O3杂质.某校研究小组利用明矾石制备氢氧化铝的流程如图: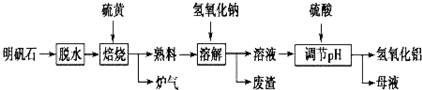
(1)配平“焙烧”过程中反应的化学方程式:
2Al2(SO4)3+3S═2Al2O3+9SO2↑.
(2)分离溶液和废渣的操作是过滤,“溶解”时反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净.
(4)“母液”中可回收的物质是K2SO4;Na2SO4.
(5)若“焙烧”过程中恰好消耗48g硫黄,则理论上最终可得到468 g氢氧化铝.
分析 根据元素守恒和得失电子守恒,硫酸铝和硫单质发生的是氧化还原反应,氧化产物和含有产物为二氧化硫,可知焙烧炉中发生反应,故生成炉气中含二氧化硫,熟料中含氧化铝、氧化铁、硫酸钾等,加入氢氧化钠和水,氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不反应,过滤,滤渣中含氧化铁,滤液中含偏铝酸钠和硫酸钾、氢氧化钠等;用硫酸调节pH,得到氢氧化铝沉淀和硫酸钠、硫酸钾,过滤得母液中含硫酸钾、硫酸钠溶质,
(1)根据元素守恒和得失电子守恒,硫酸铝和硫单质发生的是氧化还原反应,氧化产物和含有产物为二氧化硫,可知焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+9SO2;
(2)分离溶液和废渣的操作用过滤,氢氧化钠与氧化铝反应生成偏铝酸钠和水;
(3)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验;
(4)“母液”中含有硫酸盐;
(5)依据化学方程式中定量关系确定明矾石的主要成分为K2SO4•Al2(SO4)3•2Al2O3•6H2O物质的量,结合铝元素守恒计算得到氢氧化铝的理论值.
解答 解:根据元素守恒和得失电子守恒,硫酸铝和硫单质发生的是氧化还原反应,氧化产物和含有产物为二氧化硫,可知焙烧炉中发生反应,故生成炉气中含二氧化硫,熟料中含氧化铝、氧化铁、硫酸钾等,加入氢氧化钠和水,氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不反应,过滤,滤渣中含氧化铁,滤液中含偏铝酸钠和硫酸钾、氢氧化钠等;用硫酸调节pH,得到氢氧化铝沉淀和硫酸钠、硫酸钾,过滤得母液中含硫酸钾、硫酸钠溶质,
(1)硫酸铝和硫单质发生的是氧化还原反应,氧化产物和含有产物为二氧化硫,反应中硫元素化合价由Al2(SO4)3中S元素的+6价降低,单质硫中S的化合价升高,令产物中S的化合价为+x价,根据得失电子守恒可知6(6-x)=3(x-0),则x=4,所以生成产物为SO2,则反应的化学方程式为2Al2(SO4)3+3S$\frac{\underline{\;\;△\;\;}}{\;}$2Al2O3+9SO2,
故答案为:2,3,2,9SO2;
(2)分离溶液和废渣的操作用过滤,氢氧化钠与氧化铝反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:过滤,Al2O3+2OH-=2AlO2-+H2O;
(3)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验,方法为取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净,
故答案为:取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净;
(4)根据流程分析可知“母液”中含有硫酸盐中含有K2SO4、Na2SO4,都可回收利用,
故答案为:K2SO4;Na2SO4;
(5)2Al2(SO4)3+3S$\frac{\underline{\;\;△\;\;}}{\;}$2Al2O3+9SO2,依据铝元素守恒计算,若“焙烧”过程中恰好消耗48g硫黄物质的量=$\frac{48g}{32g/mol}$=1.5mol,反应的2Al2(SO4)3物质的量为1mol,K2SO4•Al2(SO4)3•2Al2O3•6H2O物质的量为1mol,
K2SO4•Al2(SO4)3•2Al2O3•6H2O~6Al(OH)3,
1 6×78
1mol m
则理论上最终可得到m=468g
故答案为:468.
点评 本题考查制备实验方案的设计,为高频考点,把握制备流程中的反应、混合物分离提纯方法为解答的关键,注意离子反应、氧化还原反应及离子检验的综合应用,侧重分析、实验能力的考查,题目难度中等.

| A. | 26g乙炔所含共用电子对数目为3 NA | |
| B. | 标准状况下,11.2L的新戊烷所含的分子数为0.5 NA | |
| C. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA | |
| D. | 标准状况下,11.2 L CCl4所含分子数为0.5 NA |
| A. | 质子数为118,电子数为179,中子数为179 | |
| B. | 原子序数为179,质量数为297 | |
| C. | 与612C的相对原子质量之比为118:6 | |
| D. | 118297X经过一次α衰变得到的116号元素原子可表示116293X |
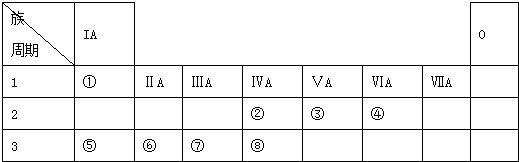
| ⅠA | ⅧA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑧ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
(1)元素④的名称是氧,从元素原子得失电子的角度看,元素④具有氧化性(填“氧化性”、“还原性”);
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:H2O>H2S>PH3(写氢化物的化学式);
(3)元素③④⑤形成的离子半径由大到小的顺序是N3->O2->Na+(用离子符号表示)
(4)元素⑦的原子结构示意图是
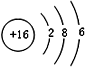 ;
;(5)最高价氧化物对应水化物酸性最强的酸是HClO4,化学性质最稳定的是Ne金属性最强的元素是Na(用化学符号表示)
| 编号 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径/10-10m | 0.77 | 0.99 | 1.86 | 0.75 | 1.17 | 1.02 | 1.43 | 0.71 | 1.52 | 0.89 |
| 最高正化合价 | +4 | +7 | +1 | +5 | +4 | +6 | +3 | +1 | +2 | |
| 最低负化合价 | -4 | -1 | -3 | -4 | -2 | -1 |
(1)②和⑧两元素所对应的氢化物,最稳定的是HF(填化学式);
(2)③和⑥两元素的最高价氧化物对应水化物的反应是放热(填“放热”或“吸热”)反应;
(3)①⑤⑦三种元素的最高价氧化物对应水化物,酸性由强到弱的顺序是H2CO3>H2SiO3>Al(OH)3(填化学式).
 或
或 .
.
 .
.