题目内容
8.如表列出了①~⑨九种元素在周期表中的位置:| ⅠA | ⅧA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑧ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
(1)元素④的名称是氧,从元素原子得失电子的角度看,元素④具有氧化性(填“氧化性”、“还原性”);
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:H2O>H2S>PH3(写氢化物的化学式);
(3)元素③④⑤形成的离子半径由大到小的顺序是N3->O2->Na+(用离子符号表示)
(4)元素⑦的原子结构示意图是
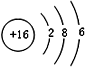 ;
;(5)最高价氧化物对应水化物酸性最强的酸是HClO4,化学性质最稳定的是Ne金属性最强的元素是Na(用化学符号表示)
分析 由元素早周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为P、⑦为S、⑧为Ne、⑨为Cl,
(1)元素④在周期表中位置,可知其处于第二周期ⅥA族;容易获得电子;
(2)同周期从左到右非金属性增强、同主族自上而下非金属性减弱,非金属性越强,气态氢化物越稳定;
(3)离子的电子层数相同时,核电荷数越大,离子半径越小;
(4)元素⑦是S元素,硫原子核外有16个电子,有3个电子层,各层电子数为2、8、6;
(5)高氯酸的酸性最强;上述元素中Na的金属性最强,化学性质最稳定的为稀有气体.
解答 解:由元素早周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为P、⑦为S、⑧为Ne、⑨为Cl,
(1)元素④处于第二周期ⅥA族,为氧元素;氧元素容易获得电子,表现氧化性,
故答案为:氧;氧化;
(2)同周期从左到右非金属性增强、同主族自上而下非金属性减弱,故非金属性:O>S>P,非金属性越强,气态氢化物越稳定,故氢化物稳定性:H2O>H2S>PH3,
故答案为:H2O>H2S>PH3;
(3)元素③④⑤分别为N、O、Na,形成的离子分别为N3-、O2-、Na+,离子的电子层数相同,核电荷数越大,离子半径越小,则离子半径由大到小的顺序是:N3->O2->Na+,
故答案为:N3->O2->Na+;
(4)元素⑦是S元素,硫原子核外有16个电子,有3个电子层,各层电子数为2、8、6,原子结构示意图为: ,
,
故答案为: ;
;
(5)高氯酸的酸性最强,其化学式为HClO4;上述元素中化学性质最稳定的为稀有气体Ne;金属性最强的为金属Na,
故答案为:HClO4;Ne;Na.
点评 本题考查了位置结构与性质关系的应用,题目难度不大,明确元素周期表结构为解答关键,注意掌握常见化学用语的概念及书写原则,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | H、D、T表示三种核素 | B. | F-离子结构示意图 | ||
| C. | 次氯酸电子式  | D. | 用电子式表示HCl形成过程 |
| A. | 手持试管给试管里的物质加热 | |
| B. | 用天平称量药品时,用手直接取放砝码 | |
| C. | 用pH试纸测定溶液的酸碱性时,一定要先把试纸用蒸馏水润湿一下 | |
| D. | 两端有大、小两匙的药匙,取用很少量的氧化铜粉末时应用小匙 |
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
(2)最高价氧化物的水化物碱性最强的是NaOH,电子式为
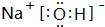 ;酸性最强的是HClO4,呈两性的是Al(OH)3;
;酸性最强的是HClO4,呈两性的是Al(OH)3;(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)在B、C、D、J、E、F、G、H中,原子半径最大的是Na.
| 元素 | 相关信息 |
| X | 原子核内无中子 |
| Y | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Z | 地壳中含量最高的元素 |
| W | 原子质量数为23,中子数为12 |
| R | 其离子是第三周期金属元素的离子中半径最小的 |
(2)Y2电子式为
 ,X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是离子、共价(填共价或离子);X与Z形成的18e-微粒的结构式为H-O-O-H.
,X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是离子、共价(填共价或离子);X与Z形成的18e-微粒的结构式为H-O-O-H.(3)砷(As)是人体必需的微量元素,与Y同一主族,As原子比Y原子多两个电子层,则砷的原子序数为33,其最高价氧化物的化学式为As2O5.该族第二到四周期元素的气态氢化物的稳定性从大到小的顺序是NH3>PH3>AsH3(用化学式表示).
(4)W在元素周期表中的位置为第三周期第ⅠA族,能够说明W和R金属性强弱的依据有cd.
a.W单质的熔点比R单质的熔点低
b.W的化合价比R的低
c.常温下W单质与水的反应很剧烈,而R单质在加热条件下与水反应现象不明显
d.W最高价氧化物的水化物的碱性比R强
(5)写出工业上冶炼R的化学反应方程式2Al2O3$\frac{\underline{\;电解\;}}{熔融}$4Al+3O2↑.
| A. | 1:1:1 | B. | 1:2:7 | C. | 4:2:7 | D. | 2:4:7 |
| A. | 26g的苯和乙炔的混合物最多可以与2mol的氢气发生加成 | |
| B. | 某温度下,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×10-3NA | |
| C. | 标准状况下,NA个NO分子和0.5NA个O2分子充分反应后气体体积为22.4 L | |
| D. | 氢气与氯气反应生成标准状况下22.4 L氯化氢,断裂化学键总数为1NA |