题目内容
8.NA为阿伏加德罗常数,下列说法正确的是( )| A. | 26g乙炔所含共用电子对数目为3 NA | |
| B. | 标准状况下,11.2L的新戊烷所含的分子数为0.5 NA | |
| C. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA | |
| D. | 标准状况下,11.2 L CCl4所含分子数为0.5 NA |
分析 A、求出乙炔的物质的量,然后根据1mol乙炔中含5对共用电子对来分析;
B、标况下新戊烷为气体;
C、乙烯、丙烯和丁烯的最简式均为CH2;
D、标况下四氯化碳为液态.
解答 A、26g乙炔的物质的量为1mol,而1mol乙炔中含5对共用电子对,故含5NA对,故A错误;
B、标况下新戊烷为气体,故11.2L新戊烷的物质的量为0.5mol,则含0.5NA个分子,故B正确;
C、乙烯、丙烯和丁烯的最简式均为CH2,故14g混合物中含有CH2的物质的量为1mol,故含3NA个原子,故C正确;
D、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和含有的分子个数,故D错误.
故选BC.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.在温度不变的条件下,在恒容密闭容器中发生如下反应:2SO2(g)+O2(g)?2SO3(g),下列叙述能够说明反应已经达到平衡状态的是( )
| A. | 容器中SO2、O2、SO3共存 | |
| B. | SO2与SO3的浓度相等 | |
| C. | 容器中SO2、O2、SO3的物质的量之比为2:1:2 | |
| D. | 反应容器中压强不随时间变化 |
3.下列各组物质中,互为同素异形体的是( )
| A. | CH4和CH3CH3 | B. | 11H和 12H | C. | O2和O3 | D. | D2O和T2O |
13.下列各项中表达不正确的是( )
| A. | H、D、T表示三种核素 | B. | F-离子结构示意图 | ||
| C. | 次氯酸电子式  | D. | 用电子式表示HCl形成过程 |
20.下列有关化学反应过程或实验现象的结论中,正确的是( )
| A. | NH3的水溶液可以导电,说明NH3是电解质 | |
| B. | 海带中的碘为碘化钾,加硝酸银溶液有黄色沉淀产生 | |
| C. | 用酒精可萃取碘水中的碘单质 | |
| D. | 向淀粉碘化钾溶液中加入溴水,溶液变为蓝色,说明Br2的氧化性强于I2 |
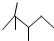 ,有机物 B 与等物质的量的 H2发生加成反应可得到有机物 A.则:
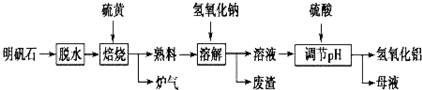
,有机物 B 与等物质的量的 H2发生加成反应可得到有机物 A.则: 盐在化学工业中有重要的应用,请回答下列问题
盐在化学工业中有重要的应用,请回答下列问题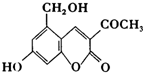 “亮菌甲素”的结构简式为如图所示,它配以辅料丙二1,3,5醇溶成针剂用于临床,而假药“亮菌甲素”是用廉价的二甘醇作为辅料.二甘醇为工业溶剂,有很强的毒性,会使肾功能衰竭.请回答下列问题:
“亮菌甲素”的结构简式为如图所示,它配以辅料丙二1,3,5醇溶成针剂用于临床,而假药“亮菌甲素”是用廉价的二甘醇作为辅料.二甘醇为工业溶剂,有很强的毒性,会使肾功能衰竭.请回答下列问题: