题目内容
6.118号元素曾经被视为元素周期表的尽头,若118号元素的某种原子记作118297X,下列有关该核素的说法中,正确的是( )| A. | 质子数为118,电子数为179,中子数为179 | |
| B. | 原子序数为179,质量数为297 | |
| C. | 与612C的相对原子质量之比为118:6 | |
| D. | 118297X经过一次α衰变得到的116号元素原子可表示116293X |
分析 在原子符号中,左下角为质子数,左上角为质量数,而对于原子来讲,质子数=电子数=核电荷数=原子序数,据此分析.
解答 解:A、118号元素的某种原子为118297X,故质子数为118,则电子数为118,则中子数为297-118=179,故A错误;
B、由于原子的质子数=原子序数,故此种元素的原子序数为118,故B错误;
C、118297X与126C的相对原子质量之比为297:12,故C错误;
D.118297X经过一次发生α衰变是放出42He,得到的116号元素的原子可表示为293116X,故D正确;
故选D.
点评 本题主要考查了原子符号的含义、中子数=质量数-质子数,原子序数=核内质子数=核外电子数以及质量数和电荷数守恒在衰变过程中的应用,难度不大.

练习册系列答案
相关题目
11.下列实验基本操作正确的是( )
| A. | 手持试管给试管里的物质加热 | |
| B. | 用天平称量药品时,用手直接取放砝码 | |
| C. | 用pH试纸测定溶液的酸碱性时,一定要先把试纸用蒸馏水润湿一下 | |
| D. | 两端有大、小两匙的药匙,取用很少量的氧化铜粉末时应用小匙 |
20.X、Y、Z、W、R是短周期中的常见元素,其相关信息如表:
(1)Y、Z、W、R四种元素的原子半径从大到小的顺序是Na>Al>N>O(用元素符号表示).
(2)Y2电子式为 ,X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是离子、共价(填共价或离子);X与Z形成的18e-微粒的结构式为H-O-O-H.
,X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是离子、共价(填共价或离子);X与Z形成的18e-微粒的结构式为H-O-O-H.
(3)砷(As)是人体必需的微量元素,与Y同一主族,As原子比Y原子多两个电子层,则砷的原子序数为33,其最高价氧化物的化学式为As2O5.该族第二到四周期元素的气态氢化物的稳定性从大到小的顺序是NH3>PH3>AsH3(用化学式表示).
(4)W在元素周期表中的位置为第三周期第ⅠA族,能够说明W和R金属性强弱的依据有cd.
a.W单质的熔点比R单质的熔点低
b.W的化合价比R的低
c.常温下W单质与水的反应很剧烈,而R单质在加热条件下与水反应现象不明显
d.W最高价氧化物的水化物的碱性比R强
(5)写出工业上冶炼R的化学反应方程式2Al2O3$\frac{\underline{\;电解\;}}{熔融}$4Al+3O2↑.
| 元素 | 相关信息 |
| X | 原子核内无中子 |
| Y | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Z | 地壳中含量最高的元素 |
| W | 原子质量数为23,中子数为12 |
| R | 其离子是第三周期金属元素的离子中半径最小的 |
(2)Y2电子式为
 ,X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是离子、共价(填共价或离子);X与Z形成的18e-微粒的结构式为H-O-O-H.
,X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是离子、共价(填共价或离子);X与Z形成的18e-微粒的结构式为H-O-O-H.(3)砷(As)是人体必需的微量元素,与Y同一主族,As原子比Y原子多两个电子层,则砷的原子序数为33,其最高价氧化物的化学式为As2O5.该族第二到四周期元素的气态氢化物的稳定性从大到小的顺序是NH3>PH3>AsH3(用化学式表示).
(4)W在元素周期表中的位置为第三周期第ⅠA族,能够说明W和R金属性强弱的依据有cd.
a.W单质的熔点比R单质的熔点低
b.W的化合价比R的低
c.常温下W单质与水的反应很剧烈,而R单质在加热条件下与水反应现象不明显
d.W最高价氧化物的水化物的碱性比R强
(5)写出工业上冶炼R的化学反应方程式2Al2O3$\frac{\underline{\;电解\;}}{熔融}$4Al+3O2↑.
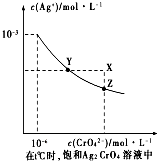 盐在化学工业中有重要的应用,请回答下列问题
盐在化学工业中有重要的应用,请回答下列问题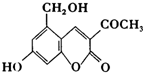 “亮菌甲素”的结构简式为如图所示,它配以辅料丙二1,3,5醇溶成针剂用于临床,而假药“亮菌甲素”是用廉价的二甘醇作为辅料.二甘醇为工业溶剂,有很强的毒性,会使肾功能衰竭.请回答下列问题:
“亮菌甲素”的结构简式为如图所示,它配以辅料丙二1,3,5醇溶成针剂用于临床,而假药“亮菌甲素”是用廉价的二甘醇作为辅料.二甘醇为工业溶剂,有很强的毒性,会使肾功能衰竭.请回答下列问题: