题目内容
6.锌及其化合物用途广泛.火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g)△H1=-930kJ•mol-12C(s)+O2(g)=2CO(g)△H2=-221kJ•mol-1
ZnO(s)+CO(g)=Zn(g)+CO2(g)△H3=+198kJ•mol-1
(1)反应ZnS(s)+C(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g)的△H4=-377.5kJ•mol-1.
反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:
2NH3(g)+CO2(g)$\stackrel{一定条件}{?}$CO(NH2)2(s)+H2O(g)△H
若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是bd.
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正=v(H2O)逆 d.容器中混合气体的密度不再改变
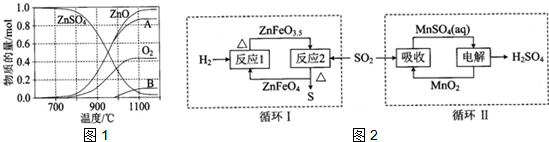
(2)硫酸锌可广泛用作印染媒染剂和木材防腐剂.ZnSO4受热分解过程中各物质物质的量随温度变化关系如图1所示.
①写出700℃~980℃时发生反应的化学方程式:2ZnSO4$\frac{\underline{\;700-980℃℃\;}}{\;}$2ZnO+2SO2↑+O2↑,物质B的化学式是SO2.
②硫酸锌分解生成的SO2经图2中的两个循环可分别得到S和H2SO4.写出循环I中反应2的化学方程式:4ZnFeO3.5+SO2$\frac{\underline{\;\;△\;\;}}{\;}$4ZnFeO4+S;循环II中电解过程阳极反应式是4ZnFeO3.5+SO2$\frac{\underline{\;\;△\;\;}}{\;}$4ZnFeO4+S;Mn2+-2e-+2H2O=MnO2+4H+.
分析 (1)①2ZnS(s)+3O2(g)═2ZnO(s)+2SO2(g)△H1=-930kJ•mol-1
②2C(s)+O2(g)═2CO(g)△H2=-221kJ•mol-1
③ZnO(s)+CO(g)═Zn(g)+CO2(g)△H3=198kJ•mol-1
将方程式$\frac{①+②}{2}$+③得ZnS(s)+C(s)+2O2(g)═Zn(g)+CO2(g)+SO2(g),焓变进行相应的改变;
反应前后改变的物理量不变时,可逆反应达到平衡状态;
(2)①700℃~980℃时发生反应时,根据图知,生成ZnO、氧气和B,根据元素守恒知,B中含有S元素,因为生成氧气失电子,则S元素应该得电子发生还原反应,所以B应该是SO2,根据反应物和生成物及反应条件书写方程式;
②ZnFeO3.5和SO2在加热条件下生.
解答 解:(1)①2ZnS(s)+3O2(g)═2ZnO(s)+2SO2(g)△H1=-930kJ•mol-1
②2C(s)+O2(g)═2CO(g)△H2=-221kJ•mol-1
③ZnO(s)+CO(g)═Zn(g)+CO2(g)△H3=198kJ•mol-1
将方程式$\frac{①+②}{2}$+③得ZnS(s)+C(s)+2O2(g)═Zn(g)+CO2(g)+SO2(g),△H4=$\frac{(-930-221)kJ/mol}{2}$+198kJ/mol=-377.5kJ/mol;
a.CO2与H2O(g)浓度相等,正逆反应速率不一定相等,所以不一定达到平衡状态,故错误;
b.该反应前后气体物质的量减少,当容器中气体的压强不再改变时正逆反应速率相等,反应达到平衡状态,故正确;
c.当v(NH3)正=2v(H2O)逆时该反应达到平衡状态,所以当2v(NH3)正=v(H2O)逆时该反应没有达到平衡状态,故错误;
d.反应前后问题密度改变,所以当容器中混合气体的密度不再改变时该反应达到平衡状态,故正确;
故答案为:-377.5;bd;
(2)①700℃~980℃时发生反应时,根据图知,生成ZnO、氧气和B,根据元素守恒知,B中含有S元素,因为生成氧气失电子,则S元素应该得电子发生还原反应,所以B应该是SO2,根据反应物和生成物及反应条件书写方程式为2ZnSO4$\frac{\underline{\;700-980℃℃\;}}{\;}$2ZnO+2SO2↑+O2↑,故答案为:2ZnSO4$\frac{\underline{\;700-980℃℃\;}}{\;}$2ZnO+2SO2↑+O2↑;SO2;
②ZnFeO3.5和SO2在加热条件下生成ZnFeO4、S,反应方程式为4ZnFeO3.5+SO2$\frac{\underline{\;\;△\;\;}}{\;}$4ZnFeO4+S;
电解硫酸锰时,生成二氧化锰和硫酸,阳极上失电子发生氧化反应,电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,
故答案为:4ZnFeO3.5+SO2$\frac{\underline{\;\;△\;\;}}{\;}$4ZnFeO4+S;Mn2+-2e-+2H2O=MnO2+4H+.
点评 本题考查电解原理、化学平衡状态判断、盖斯定律等知识点,侧重考查学生分析判断及计算能力,为高频考点,只有反应前后改变的物理量才能作为平衡状态判断依据,难点是电极反应式的书写,题目难度不大.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案 常温下,0.1mol•L-1的HX溶液与0.1mol•L-1的某一元碱ROH溶液加水稀释,两溶液pH与加水体积变化曲线如图,下列说法正确的是( )
常温下,0.1mol•L-1的HX溶液与0.1mol•L-1的某一元碱ROH溶液加水稀释,两溶液pH与加水体积变化曲线如图,下列说法正确的是( )| A. | HX为一种弱酸,ROH为弱碱 | |
| B. | a、b两点由水电离出c(H+)均为10-12mol•L-1 | |
| C. | 两溶液等体积混合 c(X-)=c(R+) | |
| D. | 两溶液等体积混合c(R+)>c(X-)>c(OH-)>c(H+) |
| A. | 福尔马林可浸制标本,利用了其使蛋白质变性的性质 | |
| B. | 歼-20飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| C. | 将地沟油制成肥皂,可以提高资源的利用率 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现碳的循环利用 |
| A. | 1 mol•L-1 Na2CO3溶液中,含CO32-数目小于NA | |
| B. | 1molFeCl3完全转化为氢氧化铁胶体后,其中胶体粒子数目为NA | |
| C. | 25℃时,1L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02 NA | |
| D. | 1 mol苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA |
| A. | 采用碳捕集和储存技术,逐步实现二氧化碳的零排放 | |
| B. | 扩大铅蓄电池、汞锌锰等含重金属元素的干电池的生产,满足消费需求 | |
| C. | 对工业废水、生活污水净化处理,减少污染物的排放 | |
| D. | 催化处理汽车尾气,减轻氮氧化物污染和光化学烟雾 |

| A. | 在浓硫酸加热下,槲皮素可发生消去反应 | |
| B. | 槲皮素分子中不含手性碳原子 | |
| C. | 槲皮素的苯溶液加入浓溴水产生白色沉淀 | |
| D. | 1mol槲皮素最多可与5molNaOH发生中和反应 |
| 操作和现象 | 结论 | ||
| A | 向用盐酸酸化的FeCl2溶液的试管中加入少量NaNO2溶液,在管口观察到红棕色气体 | 主要原因是: H++NO2-=HNO2, 2HNO2=NO↑+NO2↑+H2O | |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成. | 淀粉没有水解成葡萄糖 | |
| C | 向阿司匹林(乙酰水杨酸)中加足量饱和NaHCO3溶液,有大量气泡产生. | 阿司匹林彻底水解 | |
| D | 苯酚钠溶液中通入足量二氧化碳产生浑浊 | 苯酚的酸性弱于碳酸 | |
| A. | A | B. | B | C. | C | D. | D |
| A. | 该物质的化学式为CO2 | |
| B. | 晶体的熔沸点高、硬度大 | |
| C. | 晶体中碳原子数与C-O化学键数之比为1:4 | |
| D. | 该物质的性质与二氧化碳相似 |
 按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:
按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液: