题目内容
16.最近科学家成功的制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是( )| A. | 该物质的化学式为CO2 | |
| B. | 晶体的熔沸点高、硬度大 | |
| C. | 晶体中碳原子数与C-O化学键数之比为1:4 | |
| D. | 该物质的性质与二氧化碳相似 |
分析 根据题意知,该化合物晶体中以C-O结合为一种空间网状的无限延伸结构,所以该化合物属于原子晶体,和晶体二氧化硅的结构相似,利用均摊法确定其化学式,根据原子晶体的性质分析解答.
解答 解:A.晶体中每个碳原子均以四个共价单键与氧原子结合,每个氧原子和2个碳原子以共价单键相结合,所以碳氧原子个数比=1:2,则其化学式为:CO2,故A正确;
B.该化合物晶体属于原子晶体,所以其熔沸点高,硬度大,故B正确;
C.该晶体中,每个碳原子含有4个C-O共价键,所以C原子与C-0化学键数目之比为1:4,故C正确;
D.该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,不存在分子,属于原子晶体,二氧化碳为分子晶体,该物质的性质与二氧化碳不相似,故D错误;
故选D.
点评 本题考查晶体类型的判断及其结构的分析,该化合物和二氧化硅晶体的结构类似,根据二氧化硅的结构来分析解答即可,题目难度中等.

练习册系列答案
相关题目
7.已知: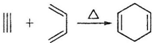 ,如果合成
,如果合成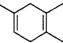 ,所用原始原料可以是( )
,所用原始原料可以是( )
 ,如果合成
,如果合成 ,所用原始原料可以是( )
,所用原始原料可以是( )| A. | 3-甲基-l,3-丁二烯和3-丁炔 | B. | 1,3-戊二烯和2-丁炔 | ||
| C. | 2,3-二甲基-1,3-戊二烯和乙炔 | D. | 2,3-二甲基-l,3-丁二烯和丙炔 |
4.某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的元素符号可能是( )
| A. | N | B. | Ne | C. | P | D. | C |
11. 2016年夏季奥运会将在“足球王国”--巴西首都里约热内卢举行,如图酷似奥林匹克旗中的五环的一种有机物被称之为奥林匹克烃,下列说法正确的是( )
2016年夏季奥运会将在“足球王国”--巴西首都里约热内卢举行,如图酷似奥林匹克旗中的五环的一种有机物被称之为奥林匹克烃,下列说法正确的是( )
 2016年夏季奥运会将在“足球王国”--巴西首都里约热内卢举行,如图酷似奥林匹克旗中的五环的一种有机物被称之为奥林匹克烃,下列说法正确的是( )
2016年夏季奥运会将在“足球王国”--巴西首都里约热内卢举行,如图酷似奥林匹克旗中的五环的一种有机物被称之为奥林匹克烃,下列说法正确的是( )| A. | 该有机物属于芳香族化合物,是苯的同系物 | |
| B. | 该有机物中只含非极性键 | |
| C. | 该有机物的一氯代物有11种 | |
| D. | 该有机物完全燃烧生成H2O的物质的量小于CO2的物质的量 |
1.环己酮是一种重要的有机化工原料.实验室合成环己酮的反应如图1:

环己醇和环己酮的部分物理性质见下表:
现以20mL环己醇与足量Na2Cr2O7和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯.其主要步骤有(未排序):
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分离提纯步骤的正确顺序是dbeca.
(2)b中水层用乙醚萃取的目的是使水层中少量的有机物进一步被提取,提高产品的产量.
(3)以下关于萃取分液操作的叙述中,不正确的是ABC.
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图2用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分漏斗静置液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞,待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是降低环己酮的溶解度;增加水层的密度,有利于分层.蒸馏除乙醚的操作中,采用的加热方式为水浴加热.
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是停止加热,冷却后通自来水.
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是60%(保留两位有效数字).

环己醇和环己酮的部分物理性质见下表:
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3、20℃) | 溶解性 |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分离提纯步骤的正确顺序是dbeca.
(2)b中水层用乙醚萃取的目的是使水层中少量的有机物进一步被提取,提高产品的产量.
(3)以下关于萃取分液操作的叙述中,不正确的是ABC.
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图2用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分漏斗静置液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞,待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是降低环己酮的溶解度;增加水层的密度,有利于分层.蒸馏除乙醚的操作中,采用的加热方式为水浴加热.
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是停止加热,冷却后通自来水.
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是60%(保留两位有效数字).
8.下列离子方程式书写正确的是( )
| A. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 用FeCl3溶液刻蚀铜电路板:Cu+Fe3+═Cu2++Fe2+ | |
| C. | 稀硝酸滴到大理石上:CO32-+2H+═H2O+CO2↑ | |
| D. | 铜和浓硝酸反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
6.在一定条件下,向2L恒容密闭容器中加入2mol X、2mol Y.发生如下反应:
X(g)+Y(g)?Z(g);△H=-a kJ•mol-1(a>0).
经50s达平衡,此时Y的物质的量为1.2mol.下列说法错误的是( )
X(g)+Y(g)?Z(g);△H=-a kJ•mol-1(a>0).
经50s达平衡,此时Y的物质的量为1.2mol.下列说法错误的是( )
| A. | 用Z表示的化学反应速率为0.016 mol•L-1•s-1 | |
| B. | 恒温恒容下,通入Ne气,增大压强,Y的浓度不减小 | |
| C. | 恒温恒容下,再充入一定量的Z,重新达到平衡时,X的物质的量分数减小 | |
| D. | 达平衡后,实际放出的热量为b kJ,则b=a |
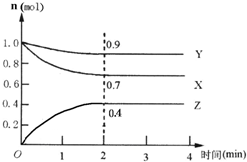 某可逆反应在某体积为5L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体).
某可逆反应在某体积为5L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体).