题目内容
16. 常温下,0.1mol•L-1的HX溶液与0.1mol•L-1的某一元碱ROH溶液加水稀释,两溶液pH与加水体积变化曲线如图,下列说法正确的是( )
常温下,0.1mol•L-1的HX溶液与0.1mol•L-1的某一元碱ROH溶液加水稀释,两溶液pH与加水体积变化曲线如图,下列说法正确的是( )| A. | HX为一种弱酸,ROH为弱碱 | |
| B. | a、b两点由水电离出c(H+)均为10-12mol•L-1 | |
| C. | 两溶液等体积混合 c(X-)=c(R+) | |
| D. | 两溶液等体积混合c(R+)>c(X-)>c(OH-)>c(H+) |
分析 A、图象PH分析可知,0.1mol/LROH溶液PH小于13,说明是弱碱,0.1mol/LHX溶液PH=1,说明酸为强酸;
B、碱溶液PH=12,酸溶液PH=2,结合溶液中离子积常数计算水电离出氢离子浓度;
C、等体积混合恰好反应生成RX溶液为强酸弱碱盐溶液,存在物料守恒;
D、等体积混合恰好反应生成RX溶液为强酸弱碱盐溶液,溶液呈酸性;
解答 解:A、图象PH分析可知,0.1mol/LROH溶液PH小于13,说明是弱碱,0.1mol/LHX溶液PH=1,说明酸为强酸,故A错误;
B、碱溶液PH=12,氢离子是水全部电离出的,酸溶液PH=2,溶液中氢氧根离子是水电离出的和水电离出氢离子浓度相同结合溶液中离子积常数计算水电离出氢离子浓度为10-12mol/L,故B正确;
C、等体积混合恰好反应生成RX溶液为强酸弱碱盐溶液,存在物料守恒为c(X-)=c(R+)+c(ROH),故C错误;
D、等体积混合恰好反应生成RX溶液为强酸弱碱盐溶液,溶液呈酸性,离子浓度大小为c(X-)>c(R+)>c(H+)>c(OH-),故D错误;
故选B.
点评 本题考查了图象分析,弱电解质的判断,电解质溶液中电荷守恒、物料守恒、离子浓度大小比较方法,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
12.分类方法在化学科学的发展中起到了非常重要的作用,下列分类标准合理的是( )
| A. | 根据酸分子中含有氢原子的个数,将酸分为一元酸、二元酸等 | |
| B. | 根据化合物在溶液中电离出的离子的类别,将化合物分为酸、碱、盐 | |
| C. | 根据化学反应中有无单质参加或生成,将化学反应分为氧化还原反应和非氧化还原反应 | |
| D. | 四种基本反应类型未能包括所有的化学反应,酸性氧化物、碱性氧化物、两性氧化物的分类包括了所有的氧化物 |
7.下列说法正确的是( )
| A. | 油脂、纤维素、淀粉都是高分子化合物 | |
| B. | 煤的干馏、蛋白质的变性和纳米银粒子的聚焦都是化学变化 | |
| C. | 酒精、甲苯、四氯化碳都能萃取碘水中的碘单质 | |
| D. | 乙烯、乙炔都可作为合成聚合物的单体 |
4.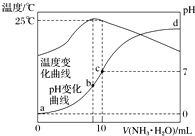 在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )
在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )
 在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )
在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )| A. | n=1.0 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | c点:c(NH${\;}_{4}^{+}$)=c(Cl-)=1.0 mol•L-1 | |
| D. | 25℃时,NH4Cl的水解常数(Kh)计算式为=$\frac{(\frac{n}{2}-0.5)×1{0}^{-7}}{0.5}$ |
11. 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于周期表的p区;溴的价电子排布式为4s24p5.
(2)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘.
(3)已知高碘酸有两种形式,分别为H5IO6(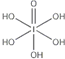 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
(4)与KI3类似的,还有CsICl2等.已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A.CsICl2=CsCl+ICl
B.CsICl2=CsI+Cl2
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,与ClO2-互为等电子体的微粒是Cl2O.(任写一个)
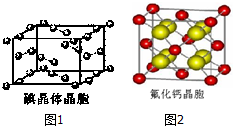
(6)图1为碘晶体晶胞结构.有关说法中正确的是AD.
A.碘分子的排列有2种不同的取向,2种取向不同
的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图2)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$ρNAa3.
 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.(1)卤族元素位于周期表的p区;溴的价电子排布式为4s24p5.
(2)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘.
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)(4)与KI3类似的,还有CsICl2等.已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A.CsICl2=CsCl+ICl
B.CsICl2=CsI+Cl2
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,与ClO2-互为等电子体的微粒是Cl2O.(任写一个)
(6)图1为碘晶体晶胞结构.有关说法中正确的是AD.
A.碘分子的排列有2种不同的取向,2种取向不同
的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图2)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$ρNAa3.
1.有人分析一些小而可溶的有机分子的样品,发现它们含有碳、氢、氧、氮等元素,这些样品很可能是( )
| A. | 脂肪酸 | B. | 氨基酸 | C. | 葡萄糖 | D. | 核糖 |
8.下列有关物理量与其单位匹配正确的是( )
| A. | 质量--g | B. | 反应速率--mol•L-1 | ||
| C. | 摩尔质量--g•mol-1 | D. | 气体摩尔体积--L•mol-1 |
 和C3H8O3(甘油)以一定比例混合,测定混合物中含碳51.3%,那么氢元素的质量分数是8.7%(取2位有效数字,下同);氧元素的质量分数是40%.
和C3H8O3(甘油)以一定比例混合,测定混合物中含碳51.3%,那么氢元素的质量分数是8.7%(取2位有效数字,下同);氧元素的质量分数是40%.