题目内容
15. 按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:
按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:(1)A,B两个装置中,属于电解池的是B(填标号).
(2)A池中,铜片是正极,电极反应式为:2H++2e-=H2↑;
(3)A池中溶解了6.5g锌时,转移了0.2mol电子.
分析 (1)B有外接电源,属于电解池,A中Zn与硫酸反应,两个电极活性不同,且为闭合回路;
(2)A池中锌比铜活泼,所以铜是正极,锌是负极,正极电极反应式为:2H++2e-=H2↑;
(3)根据n=$\frac{m}{M}$计算Zn的物质的量,结合Zn元素化合价变化计算转移电子.
解答 解:(1)B有外接电源,属于电解池,A中Zn与硫酸反应,两个电极活性不同,且为闭合回路,构成原电池,故答案为:B;
(2)A池中锌比铜活泼,所以铜是正极,锌是负极,正极电极反应式为:2H++2e-=H2↑,故答案为:正,2H++2e-=H2↑;
(3)6.5Zn的物质的量为$\frac{6.5g}{65g/mol}$=0.1mol,反应中Zn元素化合价由0价升高为+2价,故转移电子为0.1mol×2=0.2mol,
故答案为:0.2.
点评 本题考查原电池与电解池,比较基础,注意理解掌握原电池与电解池工作原理,有利于基础知识的巩固.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
3.O3氧化海水中的I-是大气中碘的主要来源,将O3通入稀硫酸酸化的NaI溶液中进行模拟研究.
(1)为探究外界条件对I2生成速率的影响,做了如下三组实验,填写表中的空白处.
(2)为测定生成I2的量,用移液管取20.00mL反应后溶液于锥形瓶中,用 c mol•L-1的Na2S2O3标准液滴定,消耗V mLNa2S2O3溶液.
已知:①H2S2O3是一种弱酸;②2Na2S2O3+I2═Na2S4O6+2NaI
①该滴定实验中除烧杯、锥形瓶外,还需要的玻璃仪器是碱式滴定管;
②该实验中可选用淀粉(填物质名称)作指示剂.
③反应后溶液中碘的含量为6.35cVg•L-1.
④甲同学认为在滴定前应微热溶液,以排除溶液中溶解的O3和O2,不然会使滴定结果偏高(填“低”或“高”).
(1)为探究外界条件对I2生成速率的影响,做了如下三组实验,填写表中的空白处.
| 编号 | 实验目的 | 反应物 | 反应前 溶液的pH | 温度 |
| 1 | 对照组 | O3+NaI+H2SO4 | 5.2 | 25℃ |
| 2 | ①探究FeCl2对反应速率的影响 | O3+NaI+H2SO4+FeCl2 | 5.2 | 25℃ |
| 3 | 探究温度对反应速率的影响 | O3+NaI+H2SO4 | ②5.2 | 5℃ |
已知:①H2S2O3是一种弱酸;②2Na2S2O3+I2═Na2S4O6+2NaI
①该滴定实验中除烧杯、锥形瓶外,还需要的玻璃仪器是碱式滴定管;
②该实验中可选用淀粉(填物质名称)作指示剂.
③反应后溶液中碘的含量为6.35cVg•L-1.
④甲同学认为在滴定前应微热溶液,以排除溶液中溶解的O3和O2,不然会使滴定结果偏高(填“低”或“高”).
10.几种短周期元素的原子半径及某些化合价见下表.分析判断下列说法正确的是( )
| 元素代号 | A | B | D | E | G | I | J | K |
| 化合价 | -1 | -2 | +4 -4 | +7 -1 | +5 -3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | A的单质是一种常见的还原剂 | |
| B. | A、I、J的离子半径由大到小顺序是A>J>I | |
| C. | G元素的单质不存在同素异形体 | |
| D. | J在DB2中燃烧生成两种化合物 |
7.已知: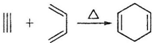 ,如果合成
,如果合成 ,所用原始原料可以是( )
,所用原始原料可以是( )
 ,如果合成
,如果合成 ,所用原始原料可以是( )
,所用原始原料可以是( )| A. | 3-甲基-l,3-丁二烯和3-丁炔 | B. | 1,3-戊二烯和2-丁炔 | ||
| C. | 2,3-二甲基-1,3-戊二烯和乙炔 | D. | 2,3-二甲基-l,3-丁二烯和丙炔 |
4.某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的元素符号可能是( )
| A. | N | B. | Ne | C. | P | D. | C |
 和C3H8O3(甘油)以一定比例混合,测定混合物中含碳51.3%,那么氢元素的质量分数是8.7%(取2位有效数字,下同);氧元素的质量分数是40%.
和C3H8O3(甘油)以一定比例混合,测定混合物中含碳51.3%,那么氢元素的质量分数是8.7%(取2位有效数字,下同);氧元素的质量分数是40%.

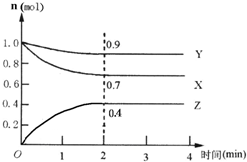 某可逆反应在某体积为5L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体).
某可逆反应在某体积为5L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体).