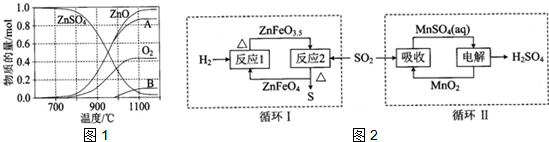
题目内容
1.2015年巴黎气候变化大会召开,旨在保护环境造福人类.下列说法不正确的是( )| A. | 采用碳捕集和储存技术,逐步实现二氧化碳的零排放 | |
| B. | 扩大铅蓄电池、汞锌锰等含重金属元素的干电池的生产,满足消费需求 | |
| C. | 对工业废水、生活污水净化处理,减少污染物的排放 | |
| D. | 催化处理汽车尾气,减轻氮氧化物污染和光化学烟雾 |
分析 A.推广碳捕集和储存技术,逐步实现二氧化碳零排放,减少温室效应;
B.加大铅酸蓄电池、含汞锌锰干电池的生产,使用后的废弃物影响环境;
C.对工业废水、生活污水净化处理,减少污染物的排放,符合社会可持续发展理念;
D.光化学烟雾的形成与汽车尾气中的氮氧化物有关.
解答 解:A.二氧化碳气体是产生温室效应的主要气体,推广碳捕集和储存技术,逐步实现二氧化碳零排放,减少了二氧化碳的排放,符合社会可持续发展理念,故A正确;B.加大铅酸蓄电池、含汞锌锰干电池的生产,废旧电池含有的铅、汞、锌、锰污染和废旧蓄电池电解液污染,会造成污染,不符合社会可持续发展理念,故B错误;
C.水污染主要来自工业、农业、生活污染物的排放,工业废水生活污水经过处理后可以节约资源,保护水源,符合社会可持续发展理念,故C正确;
D.光化学烟雾的形成主要是汽车尾气排放出的氮氧化物发生复杂的变化造成的,故D正确;
故选B.
点评 本题考查环境保护及可持续发展,注意节约资源、开发新能源、走可持续发展之路,人人有责,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11. 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于周期表的p区;溴的价电子排布式为4s24p5.
(2)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘.
(3)已知高碘酸有两种形式,分别为H5IO6(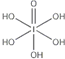 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
(4)与KI3类似的,还有CsICl2等.已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A.CsICl2=CsCl+ICl
B.CsICl2=CsI+Cl2
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,与ClO2-互为等电子体的微粒是Cl2O.(任写一个)
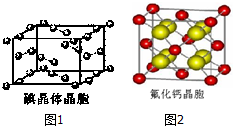
(6)图1为碘晶体晶胞结构.有关说法中正确的是AD.
A.碘分子的排列有2种不同的取向,2种取向不同
的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图2)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$ρNAa3.
 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.(1)卤族元素位于周期表的p区;溴的价电子排布式为4s24p5.
(2)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘.
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)(4)与KI3类似的,还有CsICl2等.已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A.CsICl2=CsCl+ICl
B.CsICl2=CsI+Cl2
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,与ClO2-互为等电子体的微粒是Cl2O.(任写一个)
(6)图1为碘晶体晶胞结构.有关说法中正确的是AD.
A.碘分子的排列有2种不同的取向,2种取向不同
的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图2)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$ρNAa3.
12.几种短周期元素的主要化合价及原子的原子半径数据见表:
据表中信息判断,下列有关叙述中,正确的是( )
| 元素代号 | L | M | Q | R | T |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | -2 |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| A. | M与T形成的化合物和强酸、强碱均能反应 | |
| B. | L、M的单质分别与同浓度的稀盐酸反应时,M的单质反应更剧烈 | |
| C. | Q元素在自然界中只能以化合态形式存在 | |
| D. | L与R两元素形成的化合物中,含有共价键 |
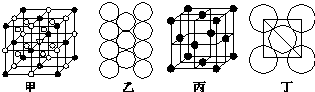
9. 甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物已略去).下列有关物质的推断不正确的是( )
甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物已略去).下列有关物质的推断不正确的是( )
 甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物已略去).下列有关物质的推断不正确的是( )
甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物已略去).下列有关物质的推断不正确的是( )| 选项 | 假设 | 结论 |
| A | 甲为Al(OH)3 | 丁可能是盐酸 |
| B | 甲为Na2CO3溶液 | 戊可能是CO2 |
| C | 甲为Fe | 丁可能是盐酸 |
| D | 甲为N2 | 戊可能是氧气 |
| A. | A | B. | B | C. | C | D. | D |
13.下列说法正确的是( )
| A. |  用如图所示装置测定空气中甲醛含量,若抽气速度过快会导致测定的甲醛含量偏低 | |
| B. | 溶质的溶解度越大,溶液的浓度越高,溶剂的蒸发速度越快,溶液的冷却速度越快,析出的晶体就越细小 | |
| C. | 将20g硝酸钠和17g氯化钾放入100ml烧杯中,加35mL水,并加热、搅拌,使溶液浓缩至约为原来的一半时,趁热过滤即可得到硝酸钾晶体 | |
| D. | 用移液管取液后,将移液管垂直伸入容器里面,松开食指使溶液全部流出,数秒后取出 |
10.几种短周期元素的原子半径及某些化合价见下表.分析判断下列说法正确的是( )
| 元素代号 | A | B | D | E | G | I | J | K |
| 化合价 | -1 | -2 | +4 -4 | +7 -1 | +5 -3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | A的单质是一种常见的还原剂 | |
| B. | A、I、J的离子半径由大到小顺序是A>J>I | |
| C. | G元素的单质不存在同素异形体 | |
| D. | J在DB2中燃烧生成两种化合物 |
11. 2016年夏季奥运会将在“足球王国”--巴西首都里约热内卢举行,如图酷似奥林匹克旗中的五环的一种有机物被称之为奥林匹克烃,下列说法正确的是( )
2016年夏季奥运会将在“足球王国”--巴西首都里约热内卢举行,如图酷似奥林匹克旗中的五环的一种有机物被称之为奥林匹克烃,下列说法正确的是( )
 2016年夏季奥运会将在“足球王国”--巴西首都里约热内卢举行,如图酷似奥林匹克旗中的五环的一种有机物被称之为奥林匹克烃,下列说法正确的是( )
2016年夏季奥运会将在“足球王国”--巴西首都里约热内卢举行,如图酷似奥林匹克旗中的五环的一种有机物被称之为奥林匹克烃,下列说法正确的是( )| A. | 该有机物属于芳香族化合物,是苯的同系物 | |
| B. | 该有机物中只含非极性键 | |
| C. | 该有机物的一氯代物有11种 | |
| D. | 该有机物完全燃烧生成H2O的物质的量小于CO2的物质的量 |
 .
.