题目内容
12.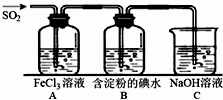 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:(1)写出由铜和浓硫酸制取SO2的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)装置A中的现象是溶液由黄色变为浅绿色.若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在过滤操作中有用到的玻璃仪器有CDE(填编号).
A.酒精灯 B.烧瓶 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(3)根据以上现象,该小组同学认为SO2与FeCl3发生氧化还原反应.
①写出SO2与FeCl3溶液反应的离子方程式2Fe3++SO2+2H2O=SO42-+2Fe2++4H+;
②请设计实验方案检验有Fe2+生成取少量A中反应后的溶液于试管中,滴入2~3滴K3[Fe(CN)6]溶液,有蓝色沉淀生成;
(4)B中蓝色溶液褪色,表明I-的还原性比SO2弱(填“强”或“弱”).
(5)若C中所得溶液只有一种溶质且pH>7,则溶液中各离子浓度大小顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
(6)工业上通过煅烧黄铁矿产生SO2来进一步得到硫酸,已知煅烧1g FeS2产生7.1kJ热量,写出煅烧FeS2的热化学反应方程式4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3408 kJ/mol.
分析 (1)Cu与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫与水;
(2)三价铁离子具有强的氧化性,在溶液能够氧化二氧化硫生成硫酸根离子,自身被还原为亚铁离子;
过滤用到的仪器有:烧杯、玻璃棒、漏斗;
(3)①三价铁离子具有强的氧化性,在溶液能够氧化二氧化硫生成硫酸根离子,自身被还原为亚铁离子;
②用K3[Fe(CN)6]溶液检验,有蓝色沉淀生成;
(4)B中蓝色溶液褪色,明发生了氧化还原反应,反应的离子方程式为:I2+SO2+2H2O=4H++2I-+SO42-,还原剂的还原性大于还原产物的还原性;
(5)若C中所得溶液只有一种溶质且pH>7,则溶质为Na2SO3,SO32-水解溶液呈碱性,氢氧根离子源于SO32-的水解、水的电离;
(6)发生反应:4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2,计算4molFeS2燃烧放出的热量,注明物质的聚集状态与反应热书写热化学方程式.
解答 解:(1)Cu与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫与水,反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)三价铁离子具有强的氧化性,在溶液能够氧化二氧化硫生成硫酸根离子,自身被还原为亚铁离子,现象是:溶液由黄色变为浅绿色,
过滤用到的仪器有:烧杯、玻璃棒、漏斗,
故答案为:溶液由黄色变为浅绿色;CDE;
(3)①三价铁离子具有强的氧化性,在溶液能够氧化二氧化硫生成硫酸根离子,自身被还原为亚铁离子,反应离子方程式为:2Fe3++SO2+2H2O=SO42-+2Fe2++4H+,
故答案为:2Fe3++SO2+2H2O=SO42-+2Fe2++4H+;
②检验有Fe2+生成的实验方案为:取少量A中反应后的溶液于试管中,滴入2~3滴K3[Fe(CN)6]溶液,有蓝色沉淀生成,
故答案为:取少量A中反应后的溶液于试管中,滴入2~3滴K3[Fe(CN)6]溶液,有蓝色沉淀生成;
(4)二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,碘是氧化剂,二氧化硫是还原剂,其反应的离子方程式为:I2+SO2+2H2O=4H++2I-+SO42-,还原剂的还原性大于还原产物的还原性,表明I-的还原性比SO2弱,
故答案为:弱;
(5)若C中所得溶液只有一种溶质且pH>7,则溶质为Na2SO3,SO32-水解溶液呈碱性,氢氧根离子源于SO32-的水解、水的电离,则溶液中离子浓度大小为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),
故答案为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
(6)发生反应:4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2,1g FeS2产生7.1kJ热量,则4molFeS2燃烧放出的热量为7.1kJ×$\frac{4mol×120g/mol}{1g}$=3408kJ,反应热化学方程式为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3408 kJ/mol,
故答案为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3408 kJ/mol.
点评 本题考查物质性质探究实验方案,试题涉及氧化性还原性强弱比较、性质实验方案的设计与评价、盐类水解、热化学方程式书写等知识,(2)中亚铁离子检验为易错点,如利用使酸性高锰酸钾溶液褪色检验时二氧化硫会影响.

| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 向NH4HSO4溶液中滴加等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-) | |
| D. | 在浓度均为0.1 mol•L-1Na2CO3、NaHCO3、NH4Cl溶液中c(H+)分别为c1、c2、c3,则c3>c2>c1 |
 、
、 、
、 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )
| A. | 使用催化剂,合成氨反应放出的热量减少 | |
| B. | 在该过程中,N2、H2断键形成N原子和H原子 | |
| C. | 在该过程中,N原子和H原子形成了含有非极性键的NH3 | |
| D. | 合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量 |
| 选项 | 现象或事实 | 解释 |
| A | Na可用于与TiCl4反应得3D打印飞机钛构件所需的原料Ti粉 | Na具有强还原性 |
| B | 明矾可用作净水 | 明矾能杀菌消毒 |
| C | SO2可用于漂白纸浆 | SO2具有强氧化性 |
| D | SiO2可用于制造光导纤维 | SiO2具有导电性 |
| A. | A | B. | B | C. | C | D. | D |
 甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中正确的是( )
甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中正确的是( )| A. | 装置乙的b极要与装置甲的X极连接 | |
| B. | 装置乙中a极的电极反应式为2Cl--2e-═Cl2↑ | |
| C. | 若有机废水中主要含有葡萄糖,则装置甲中M的电极反应式为:C6H12O6+6H2O-24e-═6CO2↑+24H+ | |
| D. | N电极发生还原反应,当N电极消耗56 L气体(标准状况下)时,则有2NA个H+通过离子交换膜 |
| A. | 亚硫酸钠水溶液显碱性:SO32-+2H2O?H2SO3+2OH- | |
| B. | SO2的水溶液显酸性:SO2+H2O?H2SO3?2H++SO32- | |
| C. | 燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2 | |
| D. | 浓NaOH溶液处理少量二氧化硫:SO2+OH-═HSO3- |
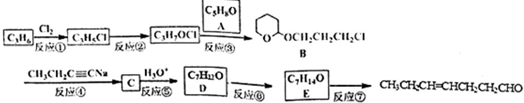
 、CH3CH2C≡CCH2CH2CH2OH;
、CH3CH2C≡CCH2CH2CH2OH;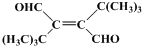 ;
;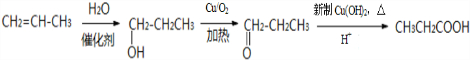 .
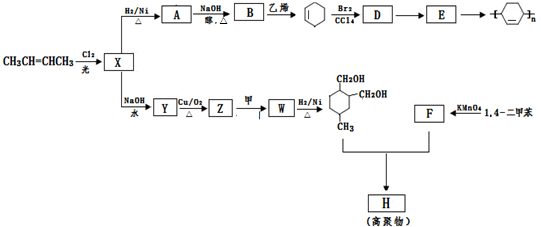
.
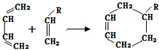 (或写成
(或写成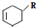 R代表取代基或氢)
R代表取代基或氢)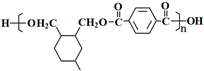 .
.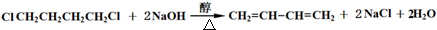 ;
;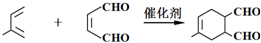 .
. 已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成,它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.
已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成,它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.